INTEGRATION DU LASER DIODE 980 NM DANS UN EXERCICE D’OMNIPRATIQUE
Auteur :
INTEGRATION DU LASER DIODE 980 NM DANS UN EXERCICE D’OMNIPRATIQUE
Dr Amandine PARA
Lire aussi sur le sujet :
La maintenance parodontale : acte essentiel aprés traitement des parodontites et peri implantites
Regénération osseuse assistée par laser
Simplicité et efficacité en hygiène bucco-dentaire
Place des lasers en Esthétique bucco dentaire quotidienne
Influence de l’utilisation d’un laser diode dans l’extraction des dents de sagesse incluses
Avulsion d'une racine fracturée en vue d'implantation assistée par laser
I. INTRODUCTION :
L’utilisation du laser est l’une des méthodes les plus récentes introduite en odontologie. Durant les dernières années, la combinaison d’un rayonnement laser avec des agents sensibles à ce rayonnement, appelée thérapie photodynamique, a été utilisée et évaluée dans plusieurs domaines de notre discipline, notamment dans les traitements parodontaux non chirurgicaux.
Cependant, il subsiste encore actuellement une controverse sur les bénéfices des protocoles de traitements parodontaux et chirurgicaux associant la technologie laser et la thérapie photodynamique, même si les effets cliniques bénéfiques sont de plus en plus mis en évidence dans les études. La maitrise des effets collatéraux de chaque type de traitement assisté au laser reste à préciser grâce à de nouvelles études cliniques avant de valider complètement les effets de cette thérapie et l'efficacité des protocoles proposés.
Le but de cet article est de décrire, à travers trois cas cliniques, l’utilisation du laser diode 980nm en omnipratique, particulièrement lors de traitements parodontaux et chirurgicaux. Les effets recherchés sont analysés à la lumière de quelques études récentes publiées sur la thérapie laser assistée.
L’intégration du laser Diode 980 nm est illustrée à travers un cas d’extraction implantation immédiate, un cas de parodontite chronique généralisée et un cas d’énucléation de kyste radiculaire d’origine dentaire.
II. Cas n°1 : TRAITEMENT CHIRURGICAL ASSISTE AU LASER, EXTRACTION-IMPLANTATION IMMEDIATE
A. Diagnostic et plan de traitement
Le patient de 53 ans se présente à la consultation avec une couronne céramo-métallique descellée sur 13. La racine de cette dent est fracturée verticalement.
Son état de santé général est bon. Au niveau dentaire, il est en cours de maintenance parodontale après traitement (assisté au laser) d’une parodontite chronique modérée généralisée.
La radiographie panoramique montre sur l’état initial de ce patient, le jour de la consultation, un ancrage radiculaire long sur la canine fracturée (fig.1)
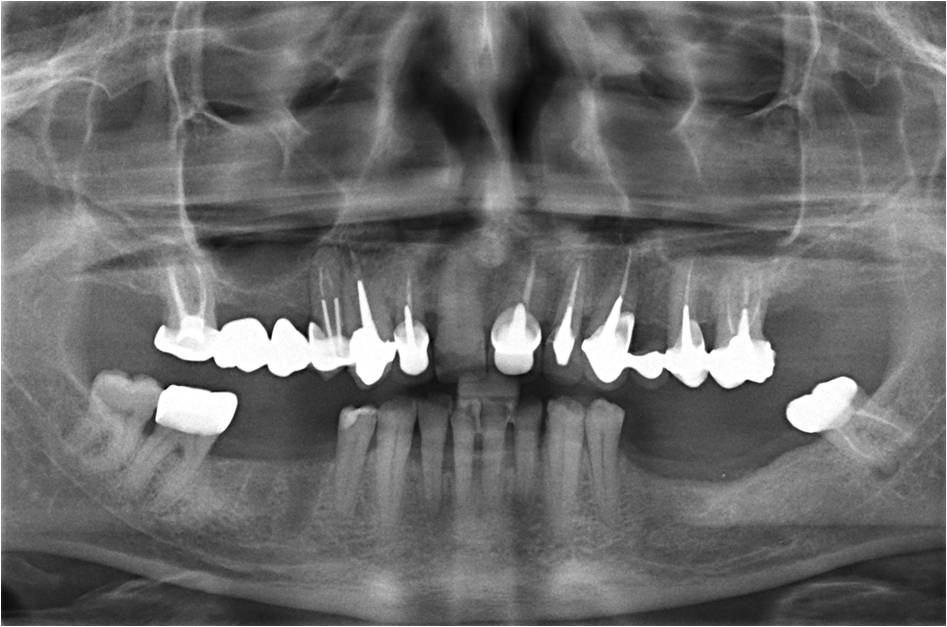
Figure 1 : état radiographique initial avec un ancrage radiculaire long dans la racine de 13 fracturée
Le contrôle bactérien récent du patient (fig. 2) après son traitement parodontal laser assisté montre l’absence de bactéries parodontopathogènes (type Aa, complexes rouge et orange).
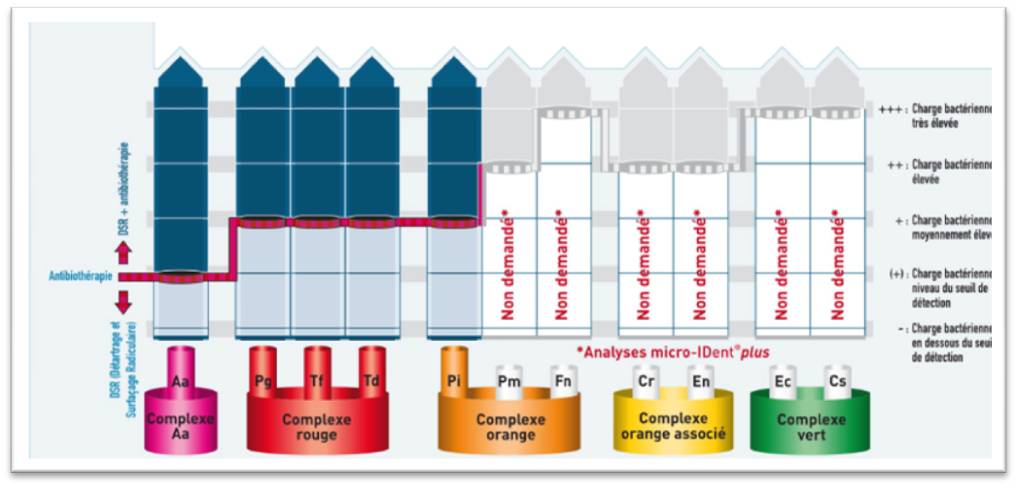
Figure 2 : flore bactérienne contrôlée 2 mois après traitement parodontal, absence de bactéries parodontopathogènes
La dent fracturée verticalement n’étant pas conservable, plusieurs propositions thérapeutiques sont envisagées en remplacement de 13 : PAP de 1 dent, bridge de 7 dents (11 à 17), prothèse implantoportée unitaire sur 13. Cette dernière solution a été retenue, avec mise en place de l’implant immédiatement après l’extraction, et temporisation par un bridge collé.
La radio panoramique réalisée en rapport 1/1 permet de mesurer la longueur et le diamètre de la racine à extraire (6mm/15mm) (fig. 3). Son remplacement est envisagé par un implant large de dimensions 5.4/12.
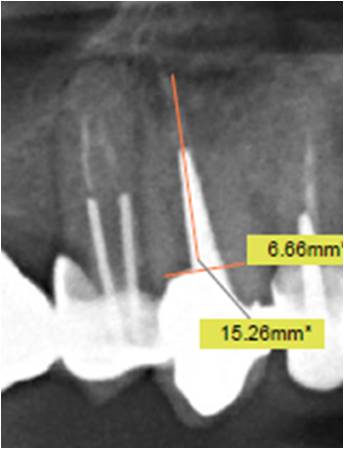
Figure 3 : mesure de la racine à extraire sur une radio panoramique préopératoire
à l’échelle 1/1
B. Thérapeutique implantaire assistée au laser
Les séquences opératoires débutent par l’extraction de la racine fracturée. L’alvéole déshabitée laisse une fenestration vestibulaire importante (fig.4)
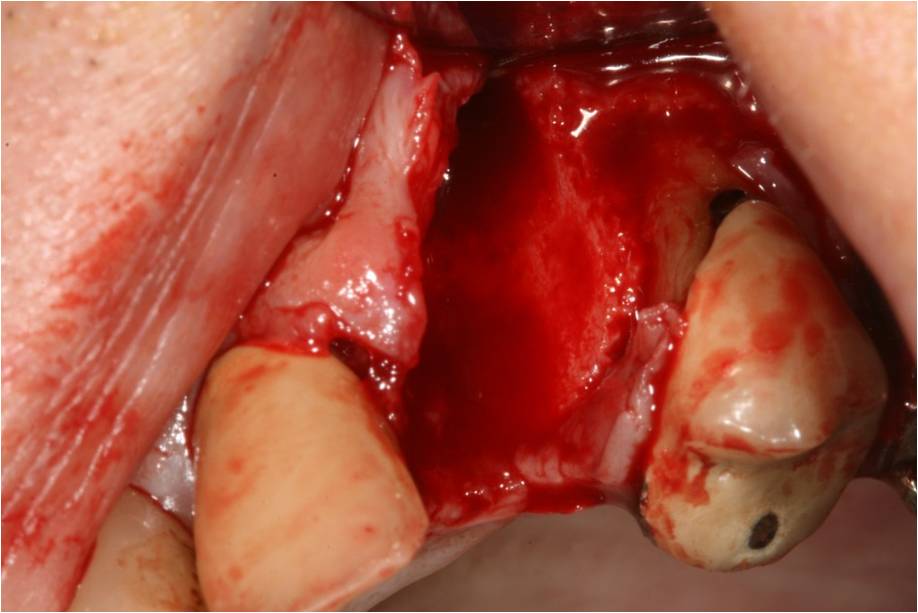
Figure 4 : fenestration osseuse vestibulaire après extraction de la racine fracturée
La cavité alvéolaire est décontaminée à l’aide du rayonnement laser diode avant la mise en place de l’implant. Les tissus cibles n’étant pas infectés par des bactéries parodonto pathogènes, on cherche ainsi à diminuer le risque de contamination liée à la prolifération bactérienne locale entre les fragments fracturés.
Les tissus cibles à atteindre sont la muqueuse et le site osseux à implanter resté au contact de la racine fracturée. Les objectifs de la mise en œuvre du rayonnement laser Diode 980 nm sont les suivants (REY G., LS sept 2009):
décontaminer le site postextractionnel par thérapie photodynamique
activer les facteurs de croissance sur le site implantaire par thérapie photothermique
potentialiser la cicatrisation gingivale par biostimulation du site en fin d’intervention.
Le laser est utilisé en mode superpulsé et les réglages retenus ici sont assez thermiques (2W, 6kHz, TiOn 50%, fibre 400µm), dus à un défaut de paramétrage de la machine utilisée. En conséquence, les paramètres « praticien » sont adaptés, avec des rafales courtes et augmentation des temps de repos entre chaque séquence de tirs.
Après curetage de l’alvéole, de l’eau oxygénée à 10 vol est déposée et laissée en place quelques minutes, afin d’oxygéner les tissus sous-jacents (fig. 5)
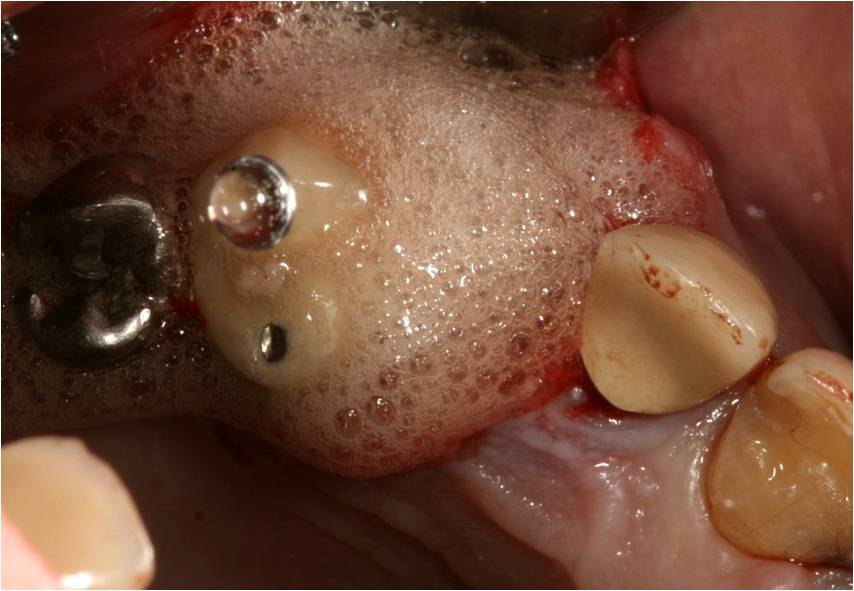
Figure 5 : oxygénation des tissus avec H2O2 laissé en place quelques minutes
Puis l’eau oxygénée est activée par le rayonnement laser 980 nm (fig. 6) afin de transformer la molécule d’oxygène fondamental (3 O2) en oxygène singulet (O2 diamagnétique) (thérapie photodynamique postextractionelle).
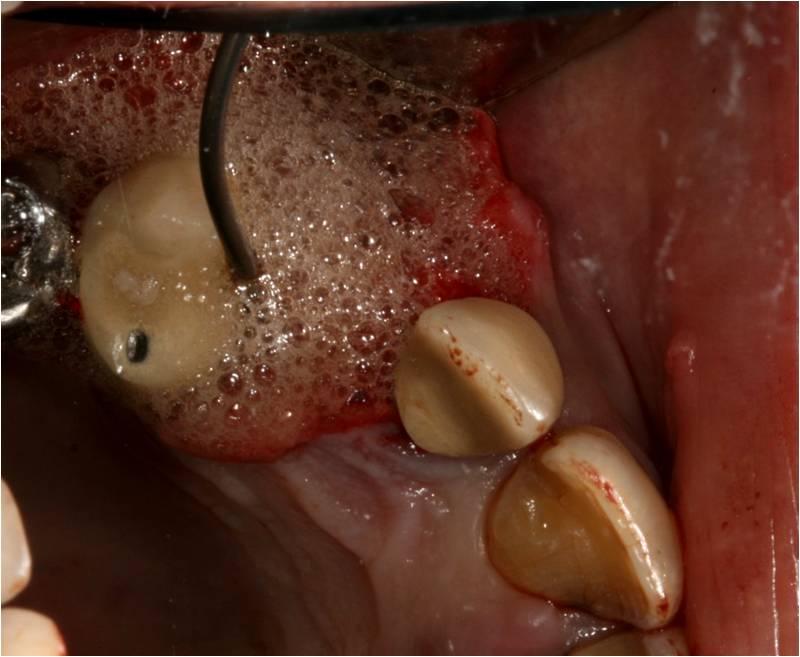
Figure 6 : activation de l’eau oxygénée avec une fibre de 400µm
Le site implantaire est ensuite préparé : le forage séquentiel est légèrement déporté vers le mur palatin de l’alvéole déshabitée (fig. 7) afin d’assurer la stabilité de l’implant dans les parois osseuse présentes
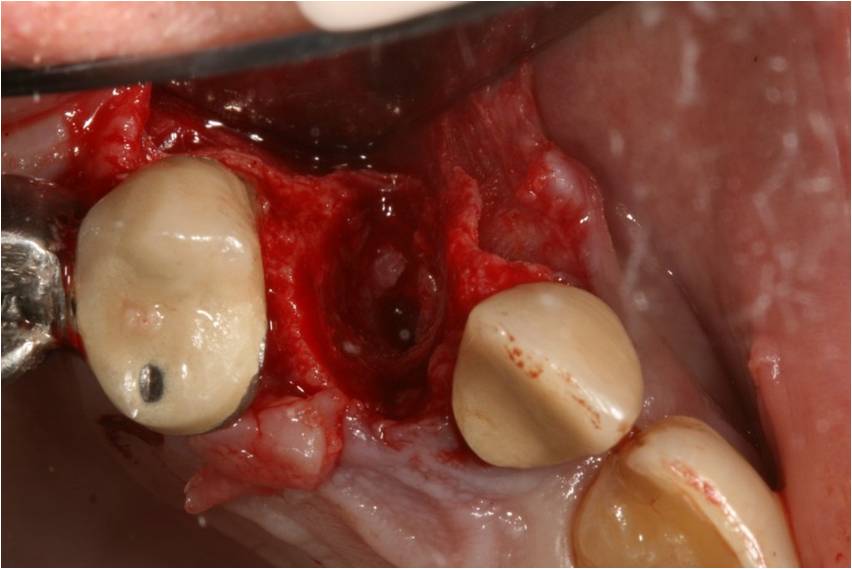
Figure 7: forage déporté en palatin
L’eau oxygénée à 10 vol est à nouveau laissée en place quelques minutes afin d’oxygéner les tissus sous-jacents, puis activée avec une fibre de 400µm (fig. 8) pour obtenir un effet de vasodilatation favorable au saignement (thérapie photothermique préimplantaire).
L’apport de facteurs de croissance sera propice à une cicatrisation optimisée après implantation.
Les effets thermiques du laser Diode utilisé ici (2W, 6kHz, TiOn 50%, fibre 400µm), ont été maîtrisés grâce à une répétition des tirs moins fréquente et à des temps de repos augmen
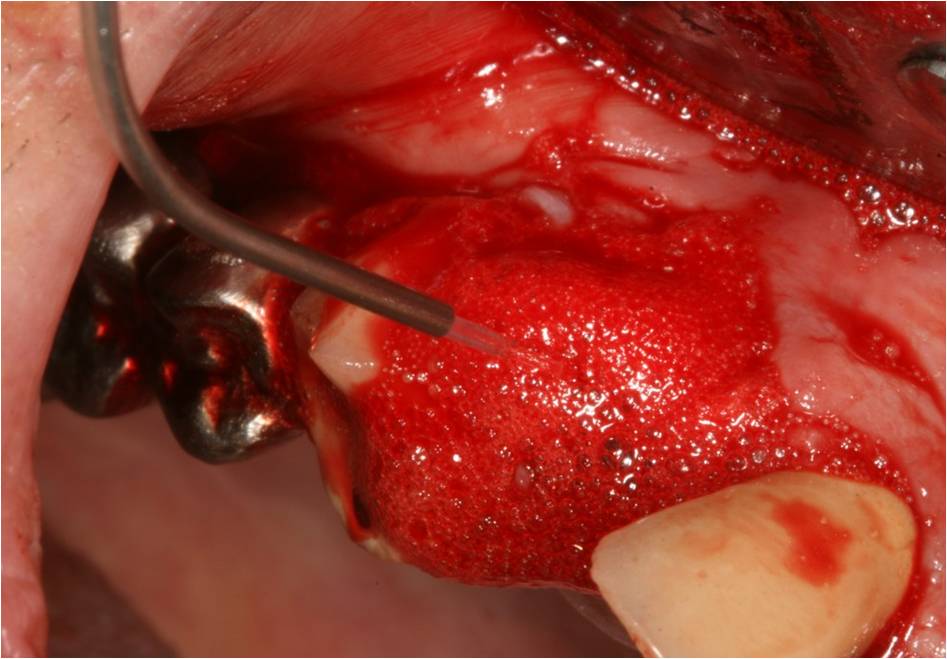
Figure 8 : activation H2O2 et obtention d’une vasodilatation
Enfin, un implant de large diamètre est mis en place: implant Kontact® (Biotech) de 5.4/12
(fig. 9).
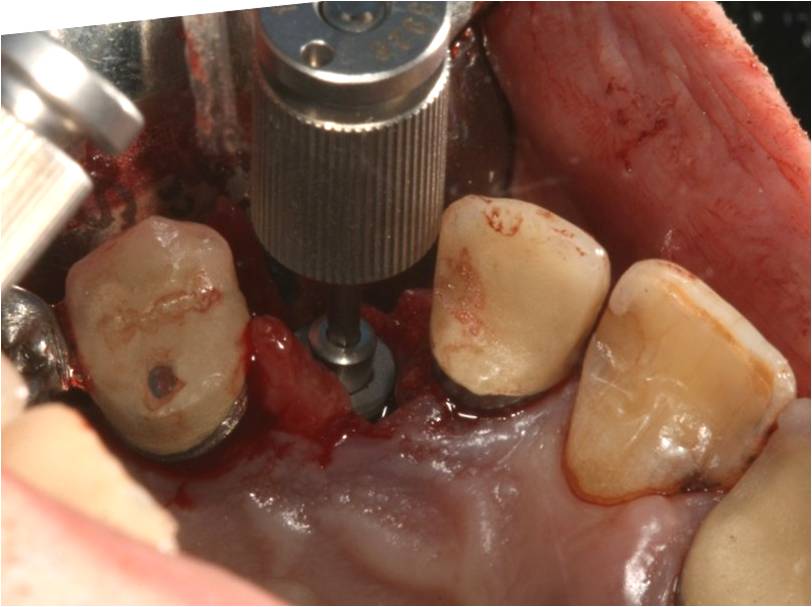
Figure 9: implant large 5.4/12 en place
Le hiatus périphérique à l’implant et la fenestration sont comblés par un matériau de régénération osseuse guidée (βTCP, Graftek® TBR) et une membrane de collagène résorbable (Neomem®, TBR) (fig. 10)
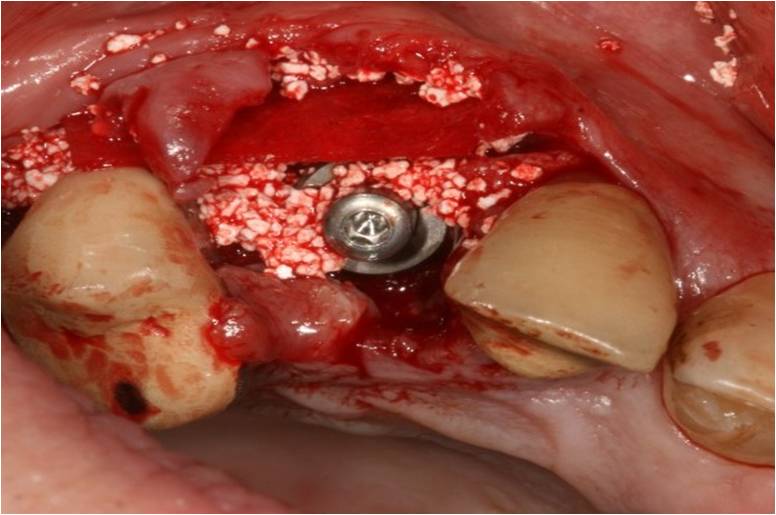
Figure 10: comblement du hiatus périphérique au βTCP et de la fenestration par une membrane collagène
Le site refermé (fig.11) est ensuite bio stimulé à 3W grâce à la lentille défocalisante du laser diode 980nm. L’application de la biostimulation par le laser de faible longueur d’onde en immédiat postopératoire améliore le taux d’épithélialisation et de cicatrisation après gingivectomie (OZCELIK O, CENK HAYTAC M., J Clin Periodontol. 2008).
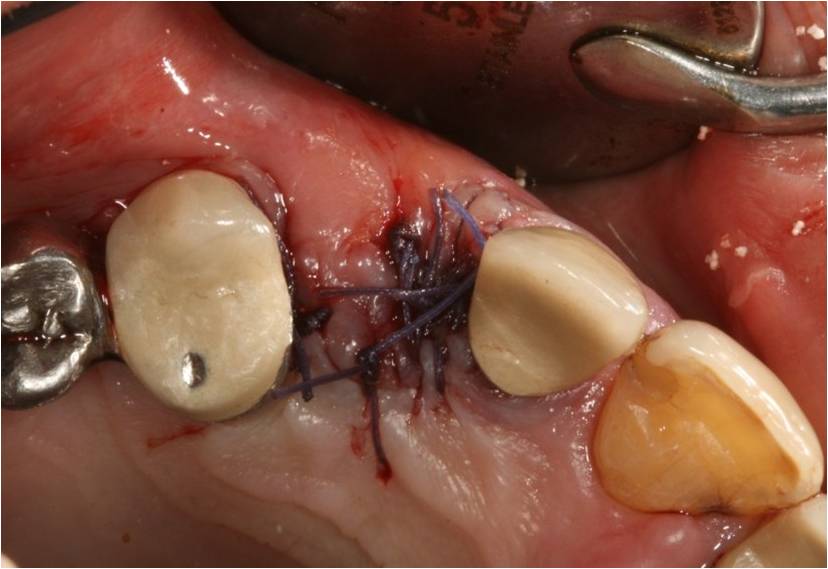
Figure 11 : le site postopératoire suturé sera biostimulé à 3W
Le patient étant en cours de maintenance parodontale (brosse électrique et utilisation quotidienne de l’hydropulseur (REY G., Efficacité des lasers en parodontologie, LS 2009)), une hygiène buccodentaire adaptée est maintenue après le traitement chirurgical.
Une radiographie rétro alvéolaire permet d’objectiver immédiatement le positionnement de l’implant par rapport aux racines adjacentes (fig. 12).
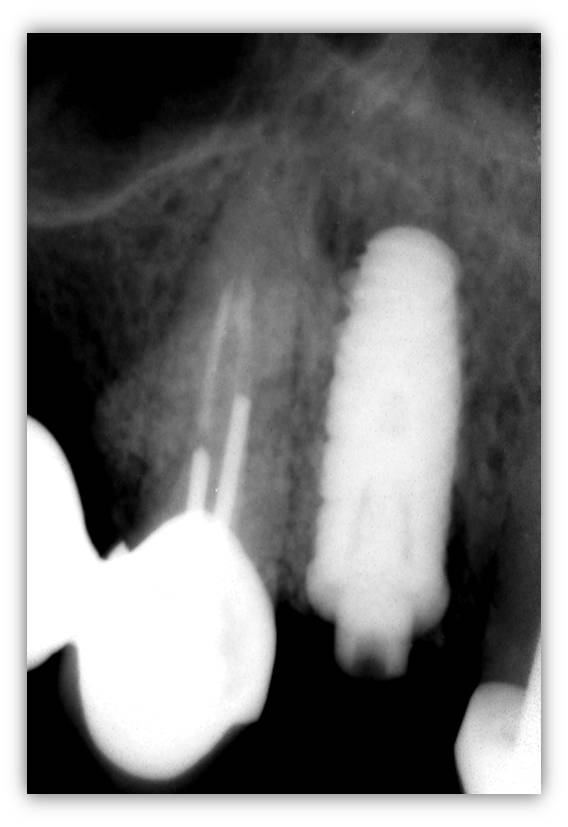
Figure 12 : radiographie de contrôle postopératoire immédiat
C. Suivi postoperatoire
A J+10, les fils sont déposés et on note une cicatrisation muqueuse satisfaisante, avec une néoformation de gencive attachée (fig. 13). La muqueuse est biostimulée à 3W à nouveau afin d’optimiser le résultat clinique.
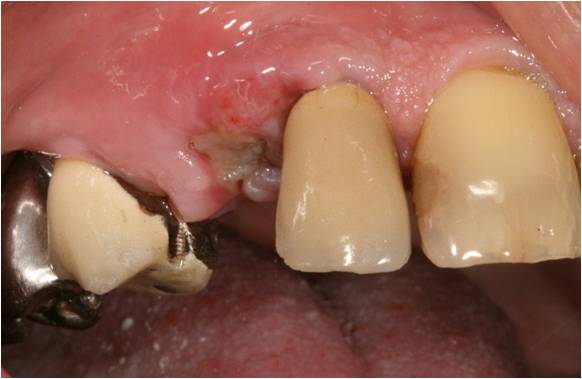
Figure 13 : contrôle à 10 jours, néoformation de gencive attachée
A J+20, une légère zone inflammatoire persiste en distal de 12 et la maturation gingivale est visible (fig. 14). La vis de couverture haute est déjà operculisée, ce qui facilitera le 2ème temps chirurgical.
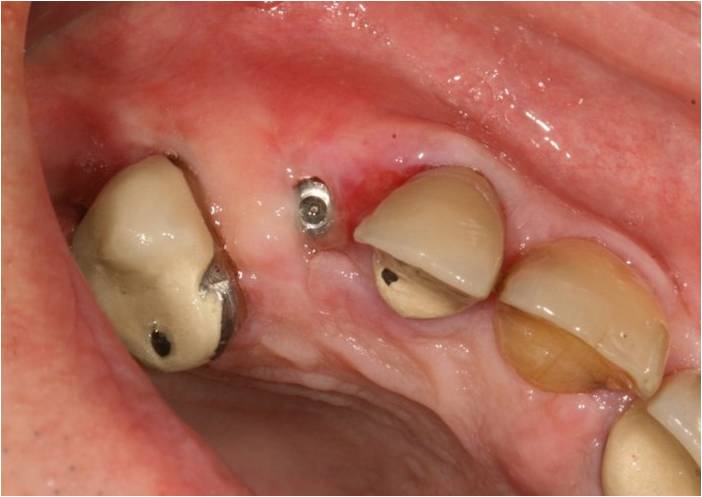
Figure 14 : maturation gingivale visible, avec operculisation de la vis de couverture
Le bridge collé est laissé en place temporairement pendant 4 mois, jusqu’à la réalisation de la couronne implantoportée.
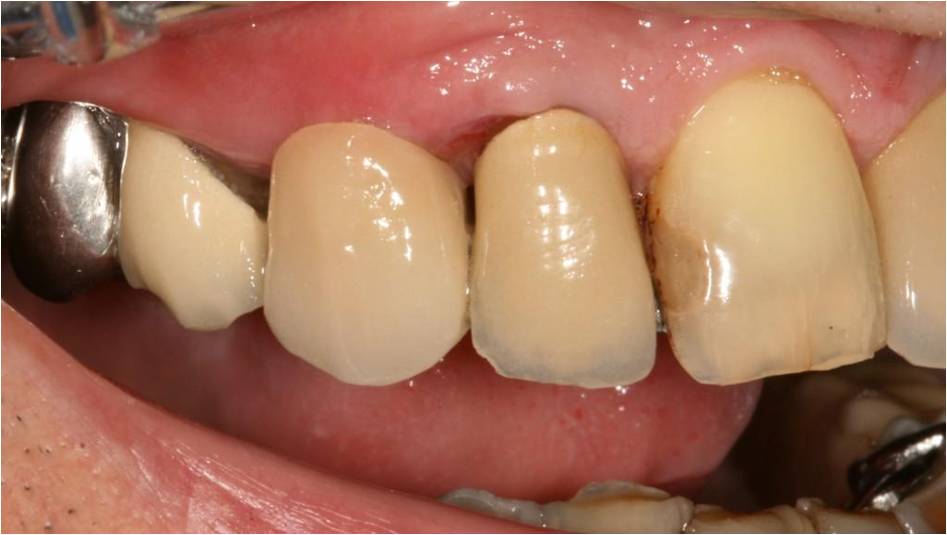
Figure 15-1 : vue vestibulaire du bridge collé en place
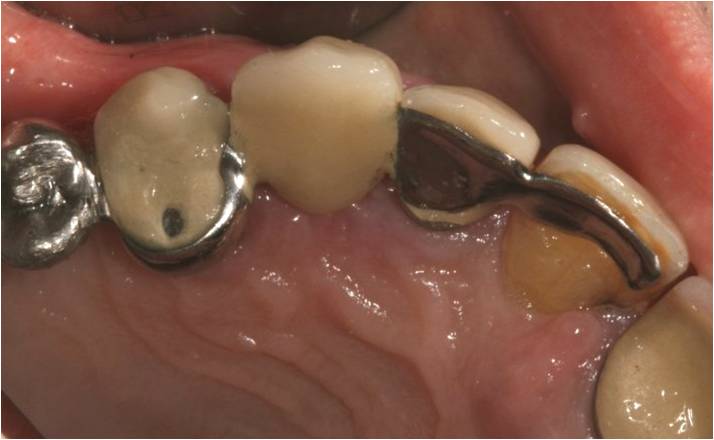
Figure 15-2 : vue occlusale, le bridge est collé sur 3 ailettes métalliques
III. Cas n°2 : TRAITEMENT PARODONTAL ASSISTE AU LASER D’UNE PARODONTITE CHRONIQUE GENERALISEE
I. Diagnostic et plan de traitement
Le patient de 53 ans se présente en consultation avec le désir d’assainir son état bucco dentaire en raison des saignements gingivaux et des mobilités de nombreuses dents.
Sur le plan général, il s’agit d’un patient stressé par son travail avec un rythme de vie très soutenu, il fume 7 à 8 cigarettes par jour et dit grincer des dents la nuit.
Il présente à l’examen endobuccal des récessions gingivales multiples, principalement localisées au niveau des secteurs incisifs et molaires (fig. 16-1, 16-2, 16-3).
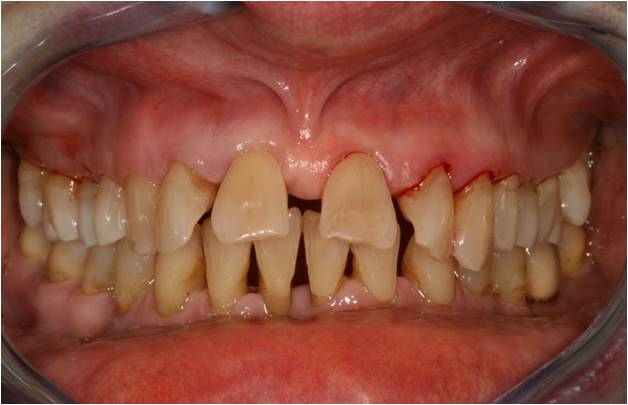
Figure 16-1 : l’examen endobuccal initial montre des récessions gingivales multiples
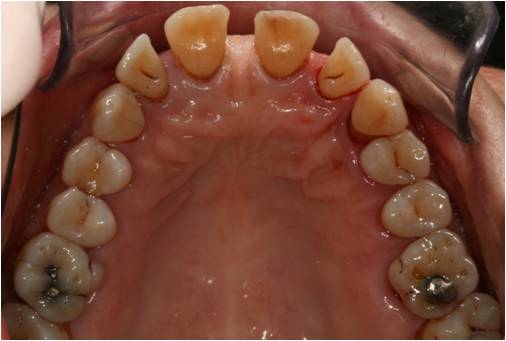
Figure 16-2 : les récessions sont également visibles sur les faces radiculaires palatines
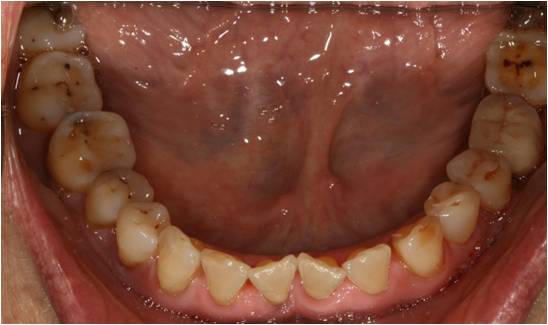
Figure 16-3 : il n’y a pas d’altération dentaire d’origine carieuse
On remarque du tartre sous gingival (fig. 17) avec un saignement au sondage (indice de saignement de 2 (Loe et Silness)) et une mobilité de 2 dans ces secteurs.
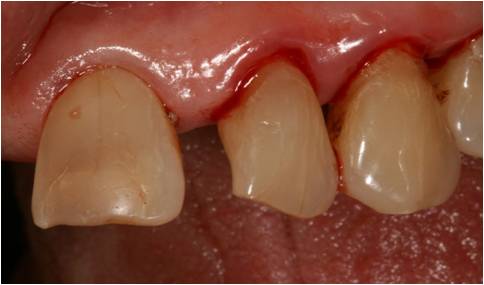
Figure 17 : tartre sous gingival et saignement au sondage
En occlusion, le patient présente une classe 2 canine avec un recouvrement antérieur important (fig. 18-1, 18-2) mais on ne note pas de traumatisme occlusal. Ses diastèmes incisifs et la position vestibulée de ses dents antérieures sont rapportés comme très anciens selon le patient qui dit ne pas avoir noté d’élargissement des espaces interdentaires récemment.
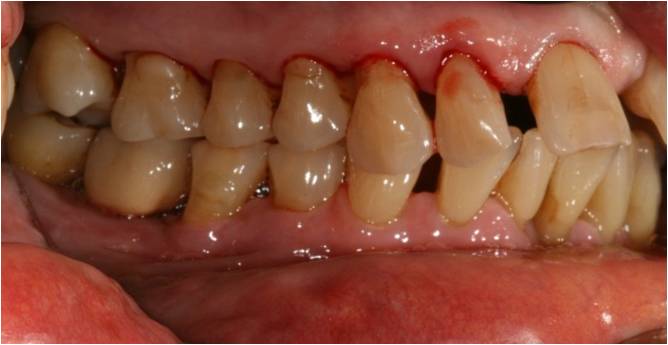
Figure 18-1 : récessions multiples dans les secteurs latéraux
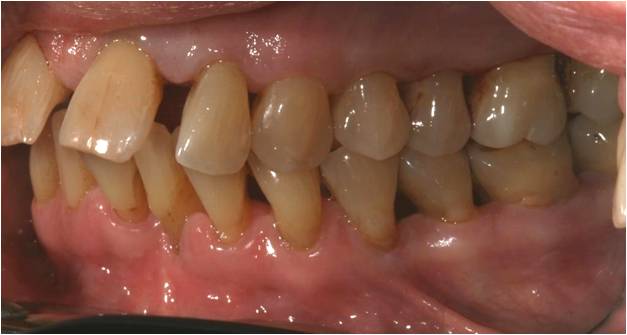
Figure 18-2 : arcades en occlusion avec un recouvrement important, pas de traumatisme occlusal sur les dents antérieures
La radiographie panoramique montre une perte osseuse généralisée (fig. 19). Au sondage on note des poches de plus de 6 mm étendues à plus de 30% des sites. Le diagnostic de parodontite chronique modérée généralisée est posé.
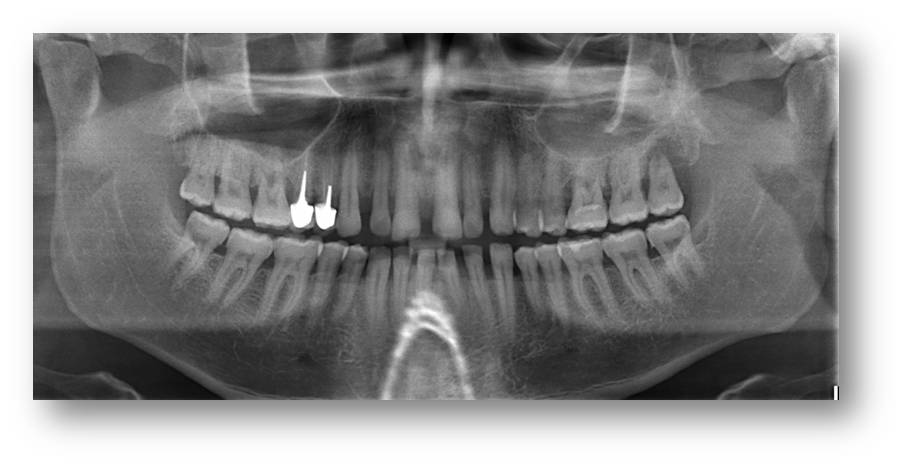
Figure 19 : radio panoramique montrant une perte osseuse généralisée, lyse terminale sur 28
Le prélèvement bactérien initial, effectué par PCR, confirme la présence de bactéries parodontopathogènes (fig. 20) du complexe rouge (Pg, Tf, Td) en quantité suffisamment importante pour préconiser une antibiothérapie (amoxicilline 2g/jr, métronidazole 1.5g/jr pendant 7 jours).
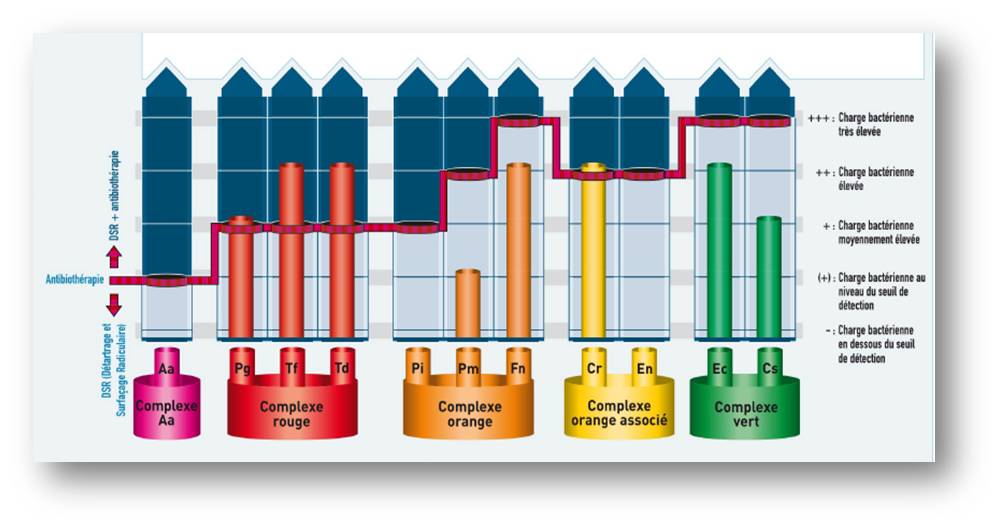
Figure 20 : résultats du prélèvement bactérien avant traitement
Le plan de traitement proposé consiste en une thérapeutique parodontale initiale assistée au laser Diode 980 nm.
II. Discussion
Les tissus cibles sont l’os et les tissus mous de soutien. La combinaison de la thérapeutique initiale classique et de la thérapie laser contribue significativement à l’amélioration de la densité osseuse radiologique et la réduction de profondeur de poche (MAKHLOUF M., DAHABA MM. et col, Photomed laser Surg 2012). Par ailleurs, la thérapie laser semble contribuer à une meilleure cicatrisation de l’épithélium gingival (MARTU S., AMALINEI C. et col, Rom J Morphol Embryol 2012)
Les objectifs du traitement proposé sont les suivants :
débridement des poches parodontales
décontamination des sites atteints et potentialisation de la réponse tissulaire par thérapie photodynamique.
stimulation de la cicatrisation gingivale par photostimulation
stabilisation du résultat par la mise en place d’un programme de maintenance
Borrajo et coll ont comparé, dans une étude clinique randomisée sur 30 patients, l’amélioration des signes tels que le saignement au sondage, l’indice de saignement papillaire et le gain d’attache clinique, entre deux groupes de patients traités par thérapie parodontale avec ou sans adjonction de l’effet laser Diode 980nm. A la fin du traitement, l’indice de saignement papillaire était significativement deux fois moins élevé que dans le groupe avec laser (p=0.014), et le saignement au sondage 19.55% moins important (p<0.001). Par contre il n’y avait pas de différence significative dans le gain d’attache clinique. Ils ont conclu à une amélioration clinique modérée significative du traitement parodontal combiné à une thérapie laser par rapport au traitement parodontal classique sans laser. (BORRAJO JL., VARELA LG., Photomed Laser Surg. 2004 Dec;22(6):509-12).
Les paramètres du laser utilisé comportant des réglages assez thermiques (2.5W, 6.3Khz, fibre de 300µm), la maitrise des effets thermiques est assurée par des paramètres praticien adaptés pour rester dans une élévation de température des tissus cibles d’environ 15° maximum.
III. Traitement parodontal laser assiste
Le traitement est réalisé en 2 séances (1 séance par arcade), chaque séance débute par une thérapeutique initiale classique de détartrage puis surfaçage ultrasonore et aéropolissage des racines accessibles.
De la polyvidone iodée est ensuite déposée dans toutes les poches parodontales (fig. 21) pour son rôle antibactérien, puis le peroxyde d’hydrogène à 3% est apporté.
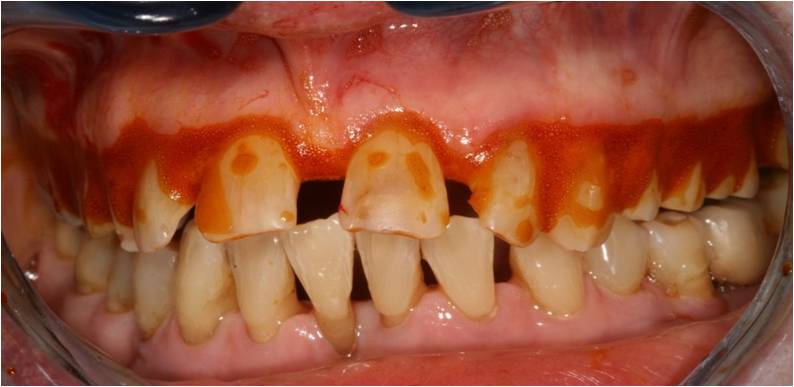
Figure 21 : Bétadine en place au fond des poches
Le peroxyde d’hydrogène à 3% est ensuite laissé en place quelques minutes afin de pénétrer dans les tissus (fig. 22).
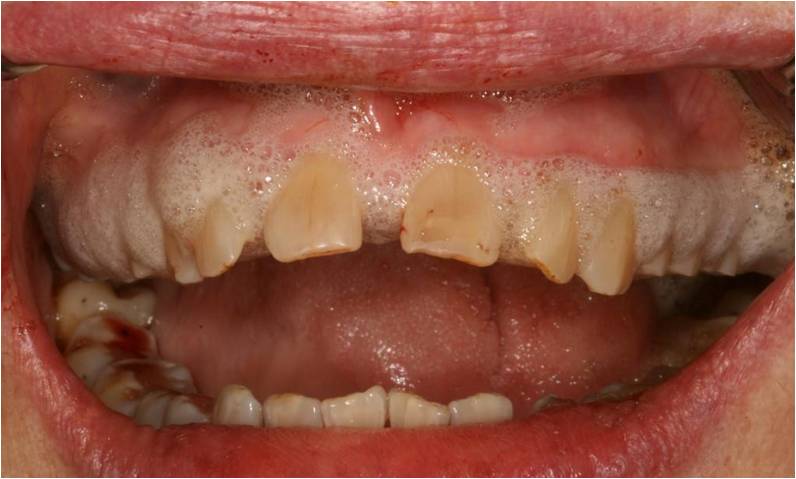
Figure 22 : Peroxyde d’hydrogène à 3%, laissé en place afin d’oxygéner les tissus avant l’activation au rayonnement laser
L’assainissement initial est complété par une thérapie photodynamique en activant l’eau oxygénée à 10 volumes par le rayonnement laser diode 980nm (fig. 23). Cela permettra la transformation des ions oxygène en oxygène singulet puissamment bactéricide (REY G., Efficacité des lasers en parodontologie, LS 2009).
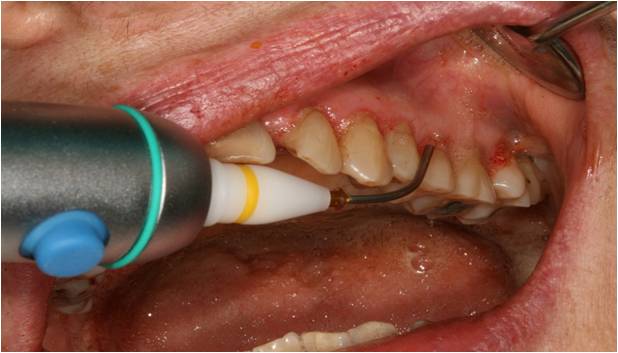
Figure 23 : activation de l’H2O2 au rayonnement laser Diode avec une fibre de 300µm
Le paramètre praticien a permis de compenser les réglages thermiques : de façon pratique, les périodes de tirs ont été effectuées 3 fois dans chaque poche sur un même quadrant de la 17 vers la 11. Puis l’eau oxygénée est réinfiltrée au fond des poches et réactivée sur le quadrant. Ainsi l’énergie thermique générée sur le 1er site (en 17) peut diminuer avant la seconde série d’activation.
On voit apparaitre un sang oxygéné, riche en facteurs de croissance favorables à la cicatrisation osseuse. (fig. 24). Il est laissé en place en fin de séance.
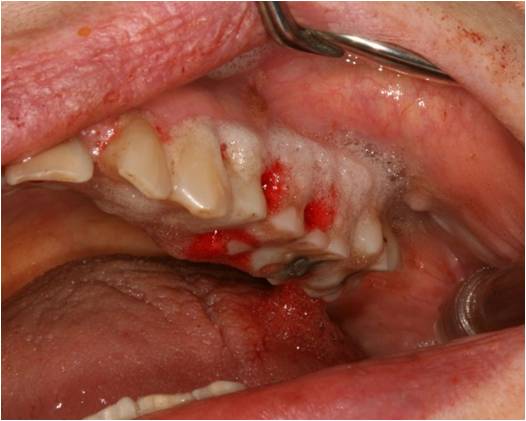
Figure 24 : sang oxygéné visible après activation de l’H2O2
IV. Soins postoperatoires
Enfin, une photostimulation à 3w est réalisée avec la lentille défocalisante sur tous les sites, afin de potentialiser la cicatrisation gingivale. La lentille est tenue à une faible distance des tissus mous afin d’obtenir un spot de 1cm environ, qui balaye la muqueuse attachée et la muqueuse alvéolaire au-delà du collet (fig. 25).
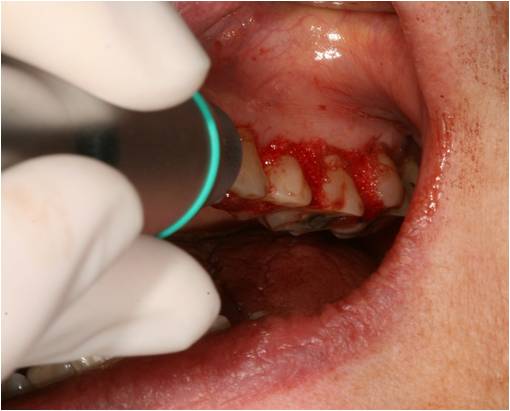
Figure 25: photostimulation à 3W avec la lentille défocalisante du laser Diode
Une gouttière de port nocturne est également réalisée, afin de soulager les tensions décrites par le patient et la 28, en parodontite terminale, a été extraite.
La thérapeutique de maintenance incluant de l’eau oxygénée et du Bicare plus (REY G, MISSIKA P. Traitements parodontaux et lasers en omnipratique ; Elsevier Masson 2010), est enseignée au patient et un rendez vous de contrôle est programmé à 2 mois.
A 2 mois postopératoires, les examens cliniques et radiographiques sont intéressants. On constate :
- une stabilisation du niveau osseux apparente sur la panoramique (fig. 26),
- un arrêt des saignements (spontanés et au brossage) et une légère diminution des mobilités.
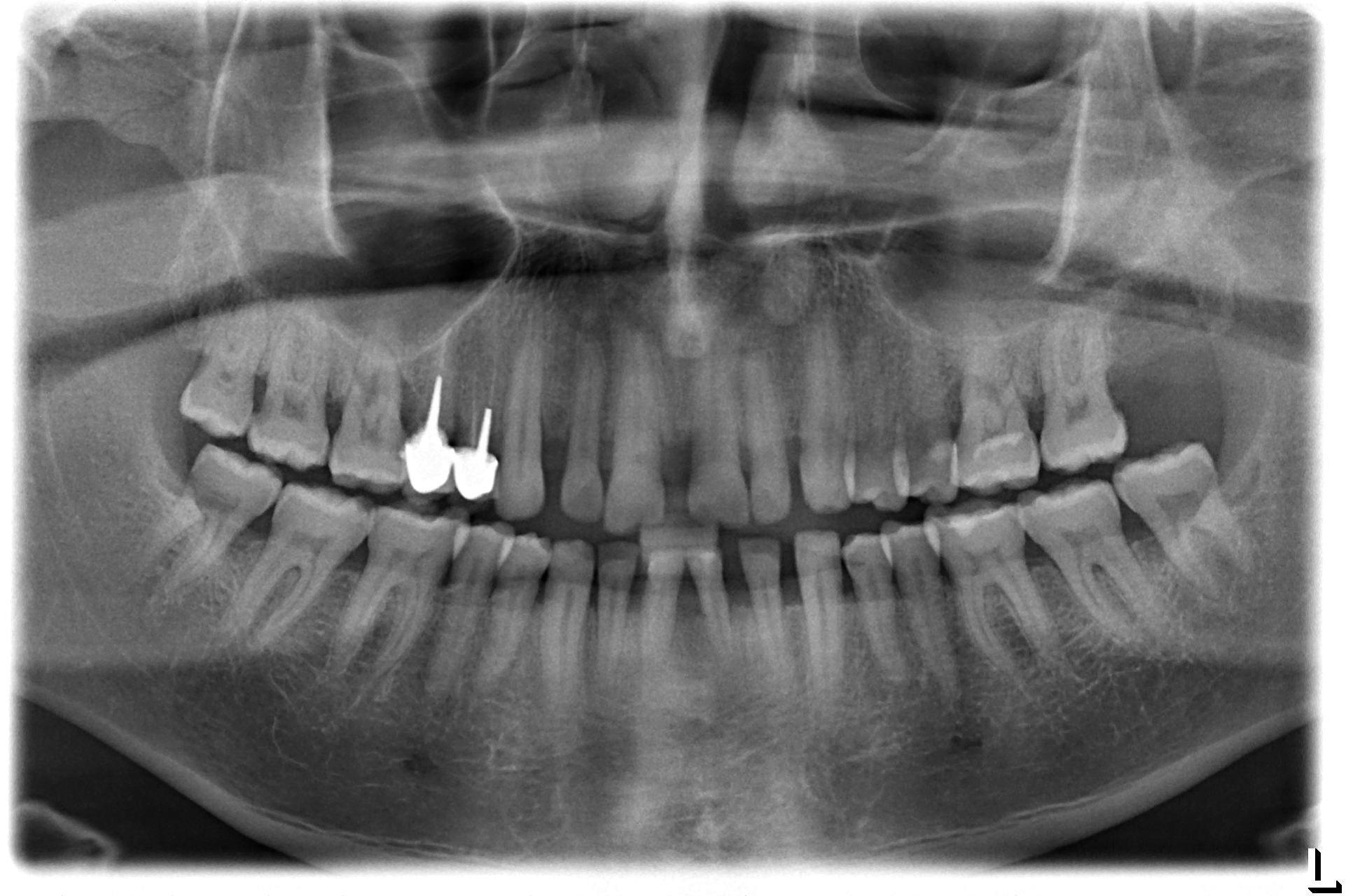
Figure 26 : état postopératoire à 2 mois, stabilisation du niveau osseux
En 2010, une équipe brésilienne (PINHEIRO SL, DONEGA JM., Lasers Med Sci. 2010 Jan;25(1):87-91) a comparé l’évolution du nombre de bactéries suite au traitement de maladies parodontales et remarque une réduction significativement plus importante du nombre de bactéries: 95.90% versus 81.24% (P<0.01).
Le laser diode a été utilisé à faible intensité (4J/cm²) avec un agent photosensible (bleu de toluidine). Dans cette étude, l’agent activé par le rayonnement laser est le bleu de toluidine et non pas l’eau oxygénée mais le résultat est favorable et on peut envisager une action tout aussi intéressante avec l’eau oxygénée, qui a d’autres avantages déjà démontrés par l’activation des molécules d’oxygène.
Une autre équipe brésilienne (BRAHAM P, HERRON C., J Periodontol. 2009 Nov;80(11):1790-8) a reconstitué in vitro les conditions de la thérapie photodynamique sur un échantillon de bactéries. Ils concluent que un adjuvant qui favoriserait simultanément l’élimination du Porphiromonas gingivalis et l’inactivation de sa protéase virulente. Selon leurs résultats, la thérapie apporterait un environnement favorable à la cicatrisation en inactivant également des cytokines de l’hôte (TNF-α et IL-1) qui empêche la réparation parodontale.
IV. Cas n°3 : TRAITEMENT CHIRURGICAL ASSISTE AU LASER, CAS D’ENUCLEATION DE KYSTE AVEC RESECTION APICALE.
A. Historique du cas
Il s’agit d’une patiente de 44 ans, suivie depuis 1 an pour une lésion radioclaire à l’apex de la 22 couronnée. Cette lésion a été traitée en première intention par voie endodontique orthograde, après dépose de la couronne et réalisation d’une couronne provisoire.
6 mois après ce traitement, la taille de l’image apicale n’a pas diminué : la radio panoramique (fig. 27), confirmée par un cliché rétro alvéolaire (fig. 28), montre une lésion volumineuse à l’apex de 22.
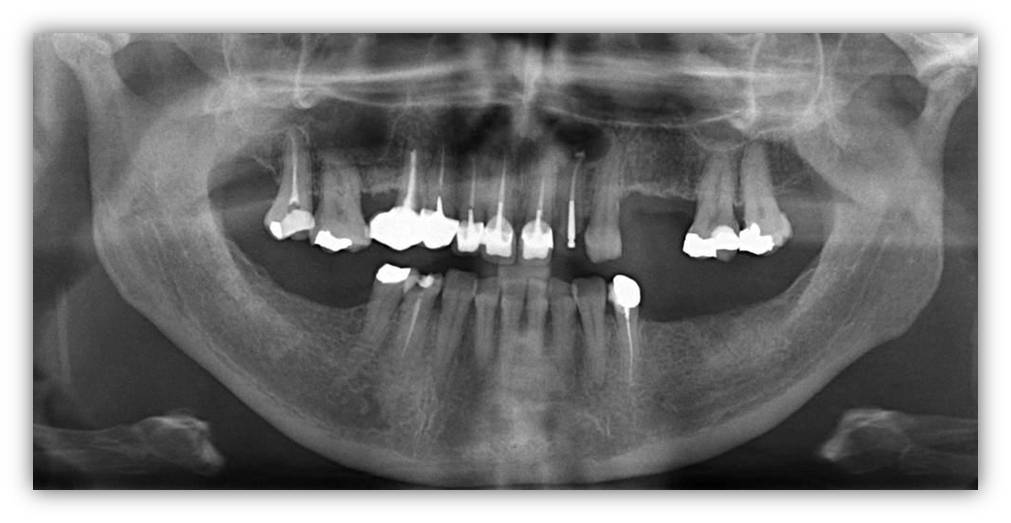
Figure 27 : panoramique initiale avant résection apicale
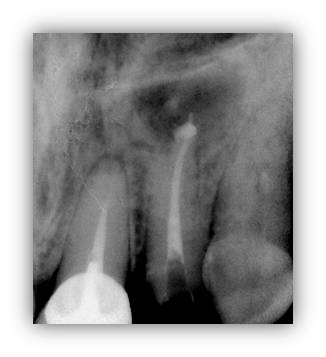
Figure 28 : radio rétro alvéolaire initiale
En accord avec la patiente, une solution conservatrice de cette dent est choisie, avec un traitement endodontique à retro et énucléation du kyste par voie chirurgicale.
B. Traitement chirurgical laser assiste
Un abord chirurgical haut est réalisé par une incision horizontale située au niveau de la muqueuse alvéolaire (fig. 29).
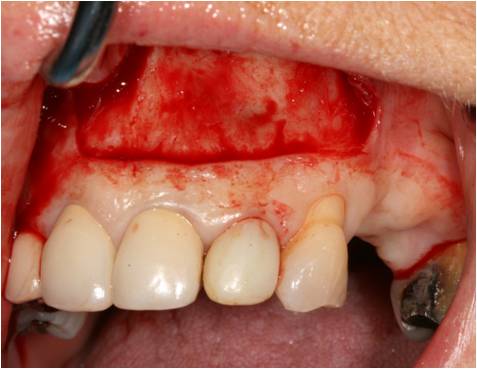
Figure 29 : abord chirurgical haut situé au dessus de la ligne mucogingivale
La paroi molle de la lésion est repérée et la cavité osseuse est élargie à la fraise boule sur turbine, jusqu’à 1mm au delà de la lésion (fig. 30).
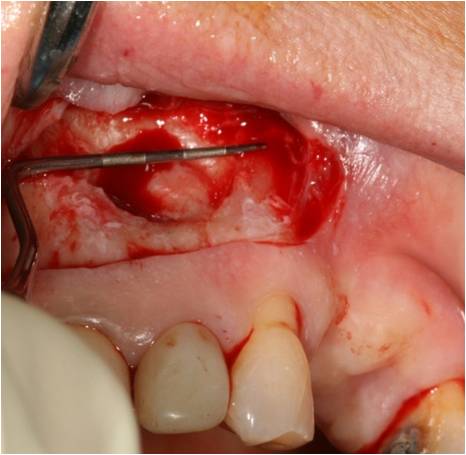
Figure 30 : fenêtre osseuse large autour de la lésion
La membrane kystique est décollée de son logement osseux grâce à une curette CK6, puis la lésion est énuclée en totalité (fig. 31-1, 31-2). La pièce opératoire conservée dans du formol liquide est adressée au laboratoire pour une analyse anatomopathologique.
Le laboratoire confirme l’aspect histologique en faveur d’un kyste folliculaire, d’exérèse complète, sans signe de malignité.
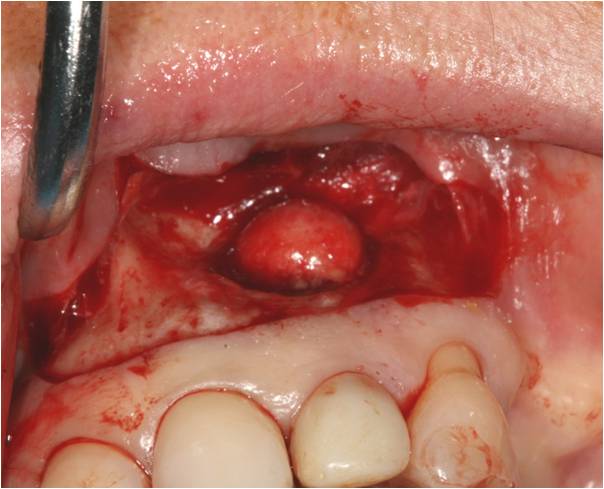
Figure 31-1 : énucléation de la lésion
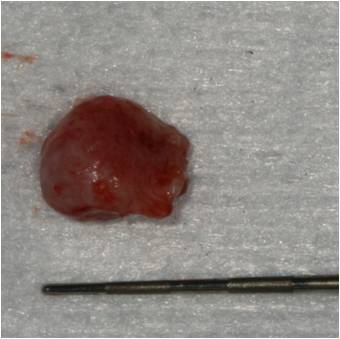
Figure 31-2 : lésion de taille importante qui sera adressée au laboratoire anatomopathologique pour analyse histologique et confirmation du diagnostic
Les parois osseuses sont curetées puis la résection apicale (fig. 32) est réalisée grâce à une fraise zekria et la racine obturée a rétro par de l’IRM.
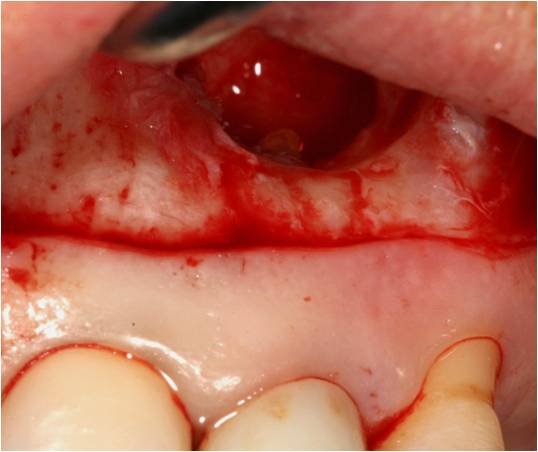
Figure 32 : cavité avant résection apicale, on aperçoit l’apex à éliminer
La thérapie photothermique est réalisée à ce stade grâce au laser diode 980nm. L’infection étant contenue dans la poche kystique, l’objectif ici est principalement d’activer les facteurs de croissance afin de potentialiser la cicatrisation osseuse.
Le laser est utilisé en mode superpulsé avec les réglages suivants : 2W, 6kHz, TiOn 50%, fibre 400µm. Le geste a été adapté en cours d’intervention, en augmentant les temps de repos entre chaque séquence de tirs.
La cavité est rincée par un mélange de Bétadine et eau oxygénée (fig. 33), puis l’eau oxygénée seule est activée par le rayonnement laser diode (fig. 34) afin d’obtenir une vasodilation et d’amener dans la cavité un sang oxygéné.
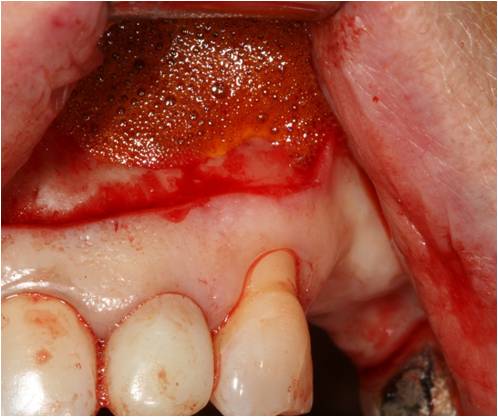
Figure 33 : la cavité est rincée par un mélange de Bétadine et d’eau oxygénée à 10 vol
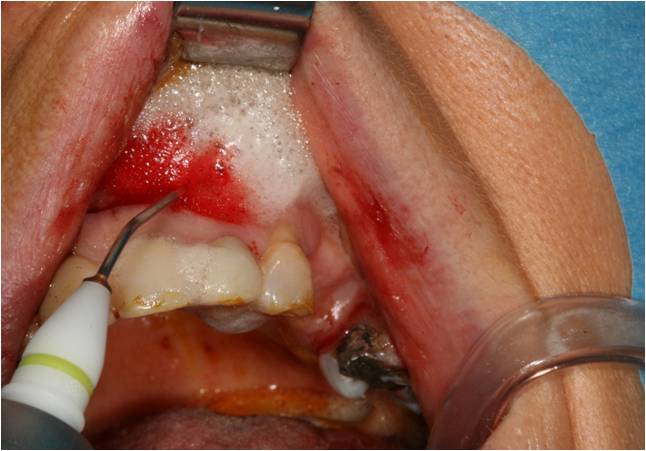
Figure 34 : eau oxygénée activée au rayonnement laser, apparition d’un sang oxygéné riche en facteurs de croissance, qui est laissé en place dans la cavité
Puis le site est refermé, suturé par un surjet et biostimulé à 3W grâce à la lentille défocalisante du laser diode (figure 35-1, 35-2). La patiente est mise sous antibiothérapie (augmentin 3g/jr) et corticothérapie (cortancyl 60mg/jr) durant 10 jours.
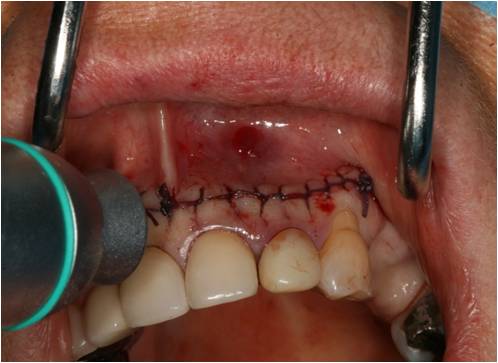
Figure 35-1 : le site opératoire est refermé puis photostimulé à 3W
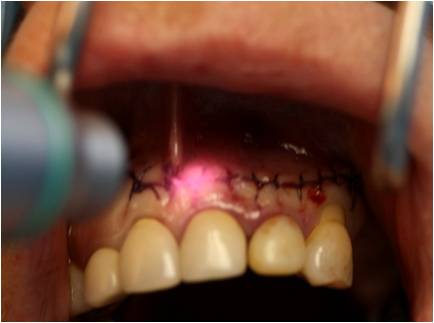
Figure 35-2 : spot de la fibre optique du laser obtenu en tenant la lentille à distance de la muqueuse
La biostimulation a été étudiée in vitro par Damante et coll en 2009, avec des lasers diode (780 et 660nm) donnant un spot punctiforme de 0.042cm² (donc presque au contact des cellules) en mode continu à 40mW pendant 3s et 5s respectivement. Il semble que la photostimulation améliore la cicatrisation globale des tissus grâce à la stimulation de croissance des fibroblastes (ßFGF), mais il ne semble pas y avoir de stimulation de la croissance des kératinocytes (KGF). Le relargage de KGF était similaire dans les groupes photostimulés au laser et ceux non stimulés. Par contre, le relargage de ßFGF était significativement 1,5 fois plus élevé dans les groupes traités. (DAMANTE CA, DE MICHELI G, Lasers Med Sci. 2009 Nov;24(6):885-91).
La biostimulation semble faite dans cette étude sans lentille de biostimulation, avec la fibre très légèrement écartée du tissu cible. La lentille défocalisante donnant un spot plus étendu et une fluence plus importante, la zone efficace stimulée dans les cas cliniques ci-dessus parait plus importante.
C. Suites postoperatoires
A 10 jours postopératoires, l’aspect de la muqueuse présente une cicatrisation satisfaisante (fig. 36), les fils sont déposés et la muqueuse est à nouveau biostimulée à 3W.
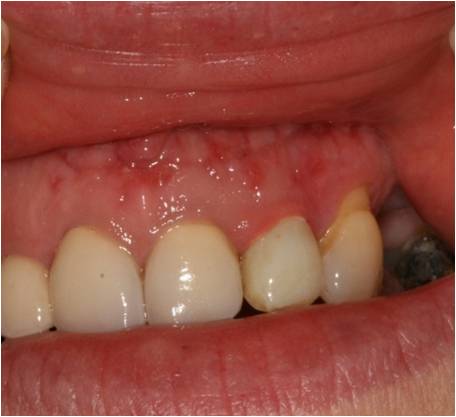
Figure 36 : état de la cicatrisation à 10 jours, après dépose des fils de suture
A 2 mois postopératoires, un début de reconstruction osseuse est appréciable radiographiquement sur la panoramique (fig. 37) et la radio rétroalvéolaire (fig. 38), et la muqueuse complètement cicatrisée (fig. 39). La bride cictratricielle résiduelle n’est pas visible lors du sourire de la patiente.
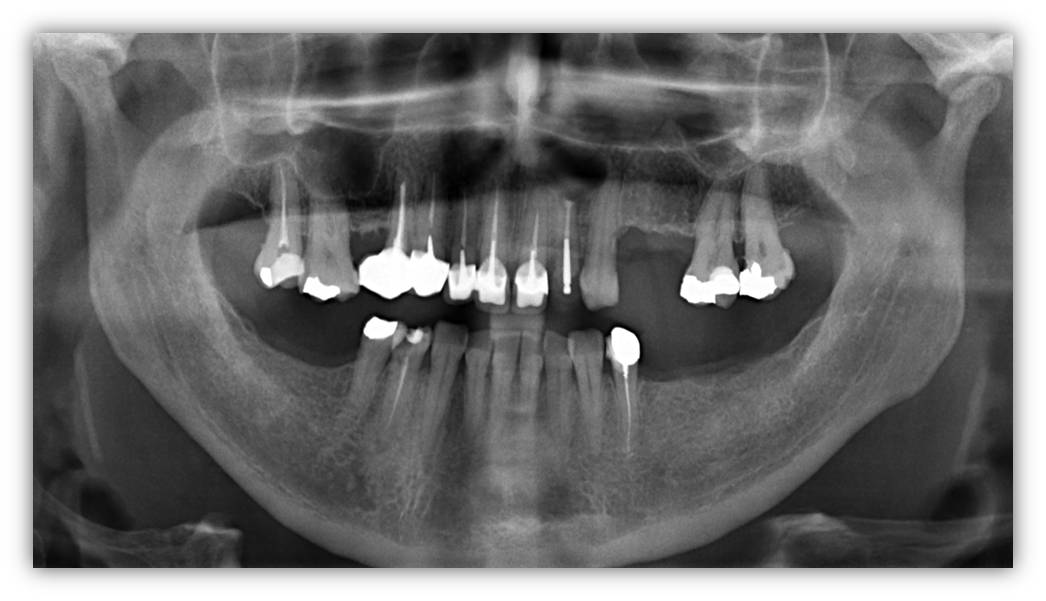
Figure 37 : panoramique de contrôle à 2 mois
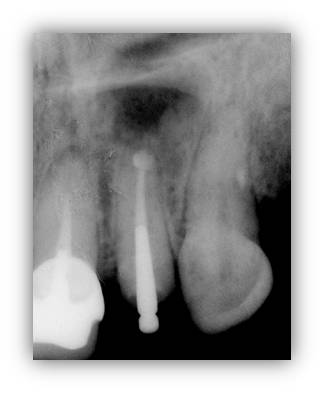
Figure 38 : la cicatrisation osseuse a débuté de façon centripète depuis les parois de la cavité.
IV. CONCLUSION
L’intérêt du laser en omnipratique se situe à différents niveaux, car il existe différentes longueurs d’onde. Le laser diode a trouvé son indication ici pour des thérapeutiques parodontale et chirurgicale, avec pour principaux objectifs de :
Décontaminer les tissus adjacents infectés en profondeur
Pérenniser le traitement effectué
Améliorer les suites postopératoires
D’autres cas permettraient d’illustrer la complémentarité du laser Erbium Yag (2940nm) avec le laser Diode dans les thérapeutiques chirurgicales en remplacement des instruments rotatifs classiques.
V. BIBLIOGRAPHIE
BORRAJO JL, VARELA LG, CASTRO GL, RODRÍGUEZ-NUÑEZ I, TORREIRA MG.
Diode laser (980 nm) as adjunct to scaling and root planing. Photomed Laser Surg. 2004 Dec;22(6):509-12.
BRAHAM P, HERRON C, STREET C, DARVEAU R.
Antimicrobial photodynamic therapy may promote periodontal healing through multiple mechanisms. J Periodontol. 2009 Nov;80(11):1790-8.
CHOI EJ, YIM JY, KOO KT, SEOL YJ, LEE YM, KU Y, RHYU IC, CHUNG CP, KIM TI.
Biological effects of a semiconductor diode laser on human periodontal ligament fibroblasts.
J Periodontal Implant Sci. 2010 Jun;40(3):105-10.
DAMANTE CA, DE MICHELI G, MIYAGI SP, FEIST IS, MARQUES MM.
Effect of laser phototherapy on the release of fibroblast growth factors by human gingival fibroblasts. Lasers Med Sci. 2009 Nov;24(6):885-91.
MAKHLOUF M, DAHABA MM, TUNER J, EISSA SA, HARHASH TA.
Effect of adjunctive low level laser therapy (LLLT) on nonsurgical treatment of chronic periodontitis. Photomed Laser Surg. 2012 Mar;30(3):160-6.
MÂRŢU S, AMĂLINEI C, TATARCIUC M, ROTARU M, POTÂRNICHIE O, LILIAC L, CĂRUNTU ID.
Healing process and laser therapy in the superficial periodontium: a histological study. Rom J Morphol Embryol. 2012;53(1):111-6.
OZCELIK O, CENK HAYTAC M, KUNIN A, SEYDAOGLU G.
Improved wound healing by low-level laser irradiation after gingivectomy operations: a controlled clinical pilot study. J Clin Periodontol. 2008 Mar;35(3):250-4.
PINHEIRO SL, DONEGÁ JM, SEABRA LM, ADABO MD, LOPES T, DO CARMO TH, RIBEIRO MC, BERTOLINI PF.
Capacity of photodynamic therapy for microbial reduction in periodontal pockets. Lasers Med Sci. 2010 Jan;25(1):87-91.
REY G, Efficacité des lasers en parodontologie, La lettre de la stomatologie sept 2009 n°43, 4-20
REY G, MISSIKA P. Traitements parodontaux et lasers en omnipratique ; Elsevier Masson 2010, p.16.