Gestion des résections apicales assistee au laser
L’objectif de l’intervention est d’éliminer la partie apicale la plus infectée et d’enfermer les bactéries canalaires par une obturation de la partie réséquée. Le débridement complet par curetage du tissu périradicualire infecté est également recherché. Un taux de succès de 90% a été documenté
Auteur :
Dr Amandine Para
Chirurgien dentiste libéral
Ancien interne en odontologie (Paris 7)
Anicenne assistante hospitalo-universitaire en prothèses (Paris 7)
DU Européen techniques laser en odontologie (Paris 7)
La résection apicale est une option thérapeutique indiquée en seconde intention pour gérer une lésion apicale, après l’échec d’un retraitement endodontique « classique » par voie orthograde, ou quand la situation clinique ne permet pas le retraitement (European Society of Endodontology, 2006). L’objectif de l’intervention est d’éliminer la partie apicale la plus infectée et d’enfermer les bactéries canalaires par une obturation de la partie réséquée. Le débridement complet par curetage du tissu périradicualire infecté est également recherché. Un taux de succès de 90% a été documenté dans plusieurs études cliniques (Von Arx, 2011).
L’acte de résection apicale allie plusieurs techniques, du domaine chirurgical et endodontique, mobilisant une instrumentation spécifique (piezzochirurgie, fouloirs endodontiques microscopiques etc…). La dentisterie assistée au laser, dont les applications efficaces sont de plus en plus décrites dans toutes les spécialités odontologiques, trouve une indication dans la gestion des résections apicales. Rappelons que le laser n’est pas une discipline, ce n‘est qu’un outil (comme la turbine, la piezzochirurgie etc…) au service d’une thérapeutique, qui va répondre à un diagnostic et s’inscrire dans un plan de traitement réfléchi.
Cet article s’intéresse aux résections apicales assistées au laser Diode et Erbium Yag, à travers deux cas cliniques. L’objectif est de proposer un protocole clinique de résection apicale assistée au laser, après avoir décrit les effets tissulaires escomptés et les réglages des paramètres des machines.
Cas clinique n°1
Le premier cas est une évolution d’un cas présenté dans un précédent article de la Lettre de Stomatologie (LS 60, Nov. 2013).
Pour rappel, la radiographie panoramique initiale du cas est représentée ci- dessous (fig.1):
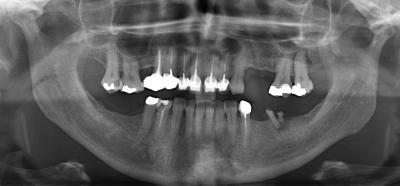
fig.1
Il s’agissait à l’époque d’une lésion apicale volumineuse d’origine endodontique sur 22, qui a été retraitée par voie orthograde puis par une résection apicale alors assistée uniquement au laser Diode 980nm pour la thérapie photodynamique peropératoire.
La comparaison des situations cliniques à J0 (fig.2) 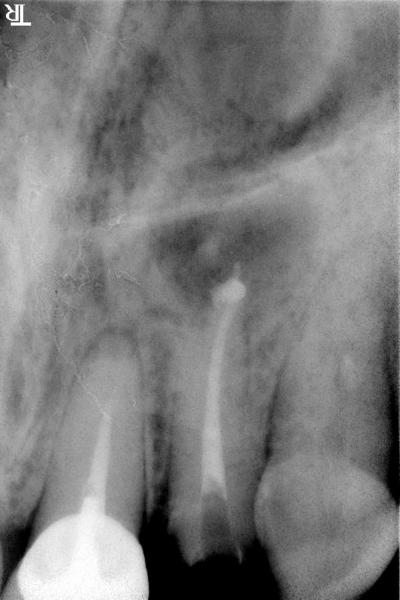
et J+5 mois (fig.3)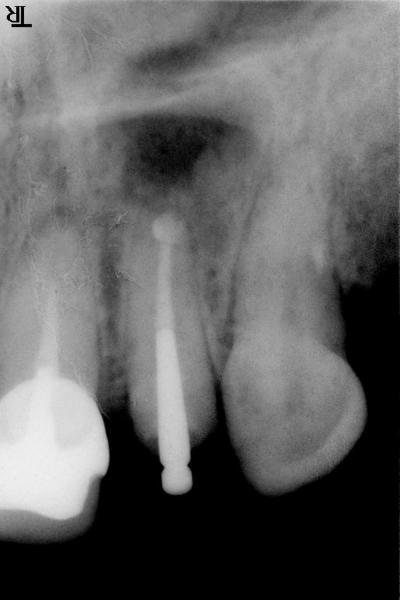 , montre à 5 mois une évolution radiologique en faveur d’une néoformation osseuse en périphérie de la cavité. Cependant, une symptomatologie clinique persistante (douleur sourde et continue en regard de l’apex de 22), une palpation douloureuse et une fistule au niveau de la zone de cicatrisation objectivent un échec de la cicatrisation à ce stade, ou « cicatrisation insatisfaisante » selon les critères établis de cicatrisation apicale (Von Arx, 2011).
, montre à 5 mois une évolution radiologique en faveur d’une néoformation osseuse en périphérie de la cavité. Cependant, une symptomatologie clinique persistante (douleur sourde et continue en regard de l’apex de 22), une palpation douloureuse et une fistule au niveau de la zone de cicatrisation objectivent un échec de la cicatrisation à ce stade, ou « cicatrisation insatisfaisante » selon les critères établis de cicatrisation apicale (Von Arx, 2011).
La décision de réintervention chirurgicale assistée au laser est prise afin de :
Éliminer tissu fibreux résiduel
Stimuler cicatrisation osseuse
Décontaminer la paroi interne de la muqueuse et l’isoler du reste de la cavité
Une attention devra être apportée à la résection osseuse afin de limiter l’extension de la fenêtre osseuse et de ne pas éliminer la quantité osseuse obtenue au cours des 5 derniers mois de cicatrisation.
Le pronostic du traitement reste réservé : les réinterventions de résections apicales donnent un taux de succès en moyenne inférieur, environ 60% (Gagliani et al., 2005).
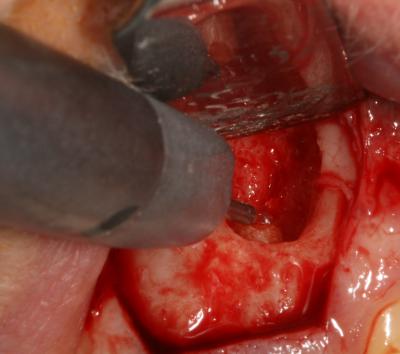
L’abord chirurgical est un lambeau de pleine épaisseur, centré sur la cavité (fig.4a)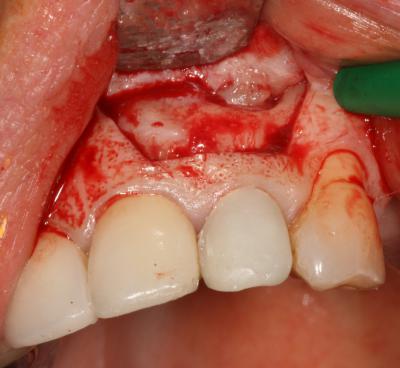
 . On remarque que le défaut de cicatrisation osseuse est lié à une compétition tissulaire en faveur du tissu fibreux car la face interne du lambeau s’invagine dans la cavité.
. On remarque que le défaut de cicatrisation osseuse est lié à une compétition tissulaire en faveur du tissu fibreux car la face interne du lambeau s’invagine dans la cavité.
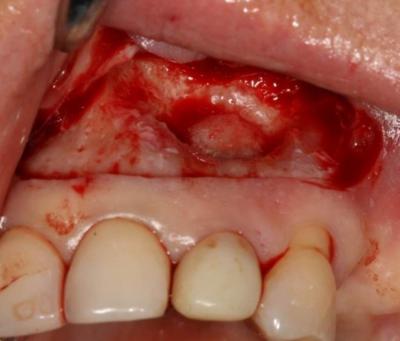
Le pédicule muqueux est sectionné et son élimination se fait à l’aide d’une curette manuelle. La résection apicale est ensuite réalisée au laser Er-Yag (pièce à main droite, montée d’un tip de 600µm) selon les réglages suivants: 220mJ, 30Hz (Fig. 5a, 5b) . La fond de la cavité est ensuite préparé et stimulé par l’effet photoablatif des impacts de tirs laser de l’Er-Yag selon les mêmes réglages.
. La fond de la cavité est ensuite préparé et stimulé par l’effet photoablatif des impacts de tirs laser de l’Er-Yag selon les mêmes réglages.
La thérapie photodynamique au laser Diode dans l’eau oxygéné à 10 vol termine la préparation pour décontaminer et oxygéner les tissus (Fig. 6), et amener des facteurs de croissance : réglage du laser Wiser en mode PDT moyen, fibre de 400µm, 6kHz, Pmax 2,5W, TiOn 50µs TiOff 117µS.
La thérapie photodynamique consiste en l'activation d'une substance par un rayonnement. Dans notre cas, l'énergie photonique du rayonnement sera transmise à un accepteur d'énergie qui est l'Oxygène fondamental qui se trouve à l'état naturel dans nos cellules et dont le pourcentage est augmenté par l'addition préalable de peroxyde d'hydrogène. Les molécules cibles deviennent porteuses d'un excès d'énergie qu'elles vont transmettre au Dioxygène (l'oxygène fondamental présent dans les tissus cibles), cette énergie photonique est à l'origine de la transformation de l'Oxygène fondamental en Oxygène singulet. (.O = O.) L'Oxygène singulet (Dioxygène diamagnétique) a une durée de vie de l'ordre de la microseconde et s'isomérise en Oxygène triplet (Dioxygène paramagnétique) d'une durée de vie de l'ordre de la milliseconde puis l'Oxygène Triplet retombe à la molécule d'Oxygène fondamental disponible pour une nouvelle excitation photonique (Rey, 2010).
Quelles sont les raisons de l’échec de la 1ère intervention 5 mois auparavant? Une résection insuffisante ? Un défaut de protection de la cavité osseuse par rapport au tissu conjonctif de la muqueuse de recouvrement ?
Différents facteurs sont à considérer, comme l'anatomie complexe du domaine apical avec une arborescence de sorties canalaires sur 2 à 3 mm en deçà de l’apex (fig. 7)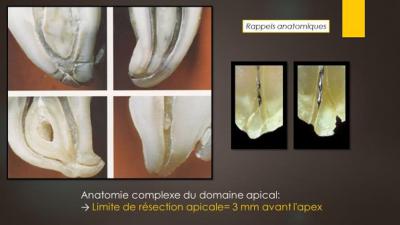 qui impose une limite de résection allant jusqu’à 3 à 4mm de l’apex.
qui impose une limite de résection allant jusqu’à 3 à 4mm de l’apex.
La préparation endodontique à retro doit également tenir compte de la complexité du domaine apical.
Dans le protocole « classique » idéal de résection apicale, les inserts piezzoélectriques de chirurgie endodontique permettent de préparer avec beaucoup de précision le canal a rétro. Dans cette étape, la visualisation à l’aide de micro-miroirs des isthmes canalaires permet de limiter les risques d’omission de ramifications apicales dans lesquelles pourraient persister des pathogènes, source de facteurs de virulence responsables des lésions osseuses (Nair, 2004). La rétro-préparation doit s’étendre sur 3 mm en direction coronaire par rapport à l’axe principal de la dent. Sa forme cylindrique devrait permettre un bon compactage du matériau d’obturation sans fragiliser la région apicale. En effet la surpréparation apicale prédispose aux microfractures et à un risque d’échec du traitement.
Dans le protocole laser assisté pour la chirurgie endodontique, le laser Erbium-Yag est proposé comme alternative à l’utilisation de piezzochirurgie et d'instruments rotatifs, en raison de sa précision de coupe, et de la possibilité biologique de réduction bactérienne et photomécanique de stimulation de la néoformation osseuse (Pourzarandian et coll, 2004).
L’intervention consiste en une action combinée des lasers Erbium Yag et Diode, pour leurs effets photoablatif et photodynamique sous eau oxygénée (Fig. 9)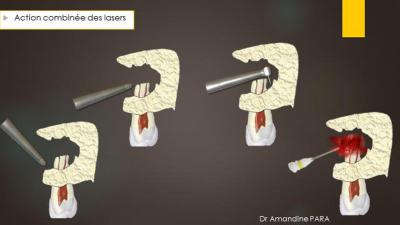 .
.
Une mauvaise gestion de la cavité vacante en fin de résection apicale a vraisemblablement participé à l’échec de la 1ère intervention. Fallait-il combler par Régénération Osseuse Guidée (ROG)? Mettre une Membrane ? Les consensus publiés dans la littérature nous aident à nouveau à orienter notre décision thérapeutique (Pourzarandian et coll, 2004).
Face à une lésion de petite étendue avec suffisamment de paroi vestibulaire pour limiter la compétition tissulaire en protégeant le caillot: il n’y a pas de différence significative entre la mise en place d’une membrane seule (résorbable ou non résorbable), une ROG ou la fermeture simple de la cavité.
Face à une ouverture de grande étendue de la cavité autorisant une invagination des tissus mous de la face interne du lambeau, il semble que le meilleur résultat est obtenu avec une membrane résorbable seule. Il n’y a pas de différence significative avec ou sans ROG, la décision se fera en fonction du sens clinique de l’opérateur.
Dans notre cas clinique, la nouvelle résection apicale laisse une cavité de taille moyenne, comblée par du biomatériau puis recouverte d’une membrane collagène (Fig.10).
A J+10 mois, la cicatrisation osseuse évaluée radiologiquement est satisfaisante (Fig.11) et permet de reconstituer la dent de façon plus durable (Fig. 12).
Cas clinique n°2
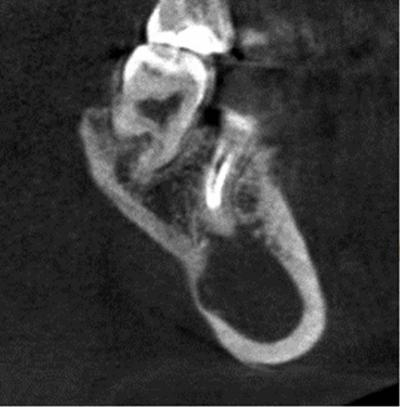
Il s’agit d’une patiente de 37 ans, en bon état de santé, qui présente une lésion apicale d’origine endodontique asymptomatique, très volumineuse sur 46 couronnée depuis 2 ans (Fig. 12)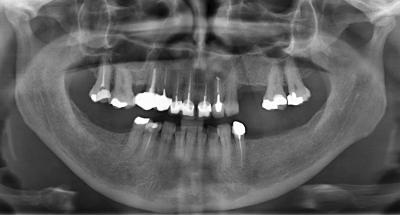 .
.
L’étendue et les rapports de la lésion avec les structures anatomiques (nerf mandibulaire, corticale inférieure) sont précisés sur un cone beam préopératoire (Fig.13)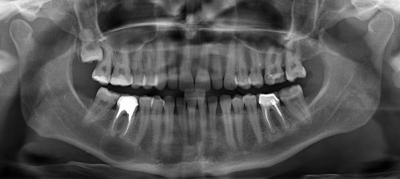 . Le cone beam représente un outil complémentaire de diagnostic indispensable dans l’exploration de lésion apicales étendues ou présentant des rapports anatomiques à risque (Lofthag-Hansen et al., 2007).
. Le cone beam représente un outil complémentaire de diagnostic indispensable dans l’exploration de lésion apicales étendues ou présentant des rapports anatomiques à risque (Lofthag-Hansen et al., 2007).
Quelles sont les solutions thérapeutiques envisagées ?
La solution d’extraction est rapidement écartée car elle entrainerait une perte de substance osseuse importante et de mauvaises conditions pour une future implantation éventuelle.
La solution retenue est conservatrice : retraitement endodontique assisté au laser, puis dans la même séance résection apicale et énucléation du kyste. La patiente est consciente que cette intervention permet de conserver la dent, mais seul un suivi radiologique à plusieurs mois permettra de confirmer la cicatrisation osseuse. Si la cicatrisation ne nous permet pas de conserver la dent à long terme, nous aurons tout de même pu potentialiser les conditions osseuses par un traitement endodontique à visée implantaire.
L’épaisseur de la corticale vestibulaire pose la question du mode d’accès à la lésion (Fig. 15a, 15b).
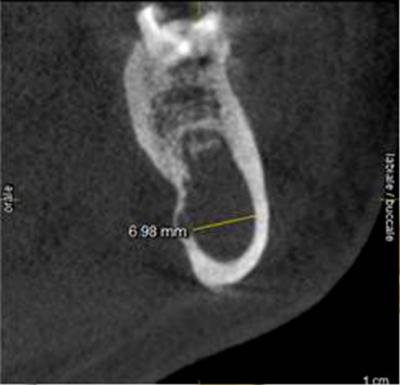
Une corticotomie du volet vestibulaire réalisée au laser Er-Yag seul risque d’être relativement longue. Une ostéotomie à la fraise boule dans l’épaisseur initiale de la corticale, suivie d’une fin d’ostéotomie à l’Er-Yag est envisagée dans cette situation.
Les tissus cibles sont l’os, le cément et les tissus mous, à atteindre par un effet ablatif de l’Er-Yag et à décontaminer par thérapie photodynamique du laser Diode sous eau oxygéné à 10 vol.
Le prérequis à l’intervention chirurgicale est de nettoyer dans la séance tout le réseau canalaire radiculaire dont le traitement endodontique initial est en cause (Rey et coll, 2014).
Le retraitement endodontique par voie orthograde sera assisté au laser diode, en mode PCT moyen 2.3W de puissance moyenne, fibre de 200µm, TiOn 33µs et TiOff 133µs (Fig.16a, 16b, 16c).
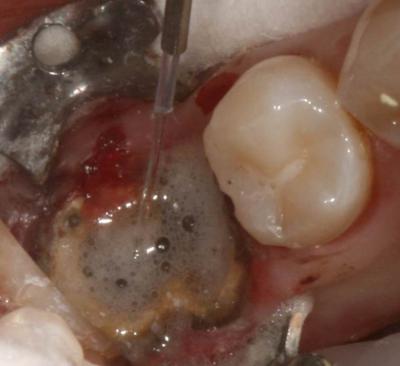
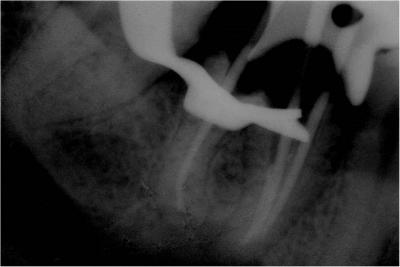

Puis la phase chirurgicale de résection apicale et d’énucléation du kyste est réalisée à l’aide d’un laser Er-Yag pour terminer la fenêtre osseuse (initiée à la fraise boule sur turbine): pièce à main droite booster, tip de 600μm, 250mj, 20Hz. Le repérage préalable des éléments anatomiques sur le cone beam a sécurisé l’intervention par rapport au nerf mandibulaire (Fig 17a, b, c).
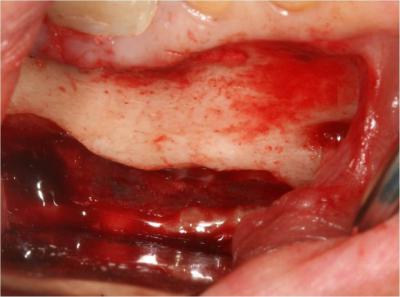
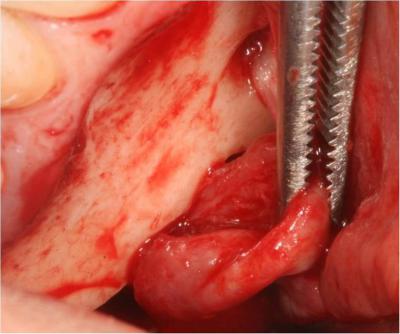
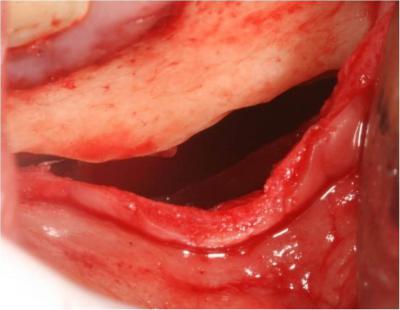
Le kyste est ensuite énucléé à l’aide d’instruments adaptés puis adressé au laboratoire anatomopathologique pour être analysé (Fig.18).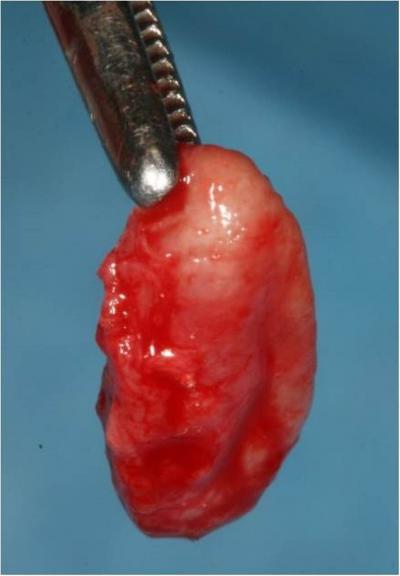
En fin d’intervention, la cavité osseuse déshabitée est décontaminée et stimulée par
l’effet photodynamique du laser Diode sous eau oxygénée à l’aide d’une fibre de 400μm en mode PDT moyen (2.5W, Ton 50μs, Toff 117μs, 6kHz). Le caillot de sang oxygéné est laissé en place sans autre comblement (Fig.19)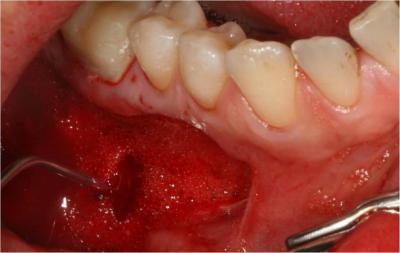 , puis le site est suturé et photostimulé à l’aide d’une lentille défocalisante (réglage moyen, 6 w – Ton 20 µs – Toff 40 µs – 16700 Hz – P moy. 2 W, 8 x 30 secondes) (Fig. 20).
, puis le site est suturé et photostimulé à l’aide d’une lentille défocalisante (réglage moyen, 6 w – Ton 20 µs – Toff 40 µs – 16700 Hz – P moy. 2 W, 8 x 30 secondes) (Fig. 20).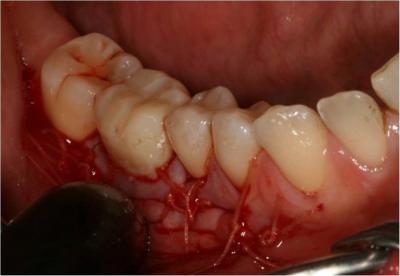
Une prescription postopératoire est préconisée à la patiente : amoxicilline (2g/jr, 10
jours), cortancyl (60mg, 4 jours), codoliprane (500mg toutes les 4h, en cas de
douleur).
La radiographie postopératoire immédiate (Fig.21) 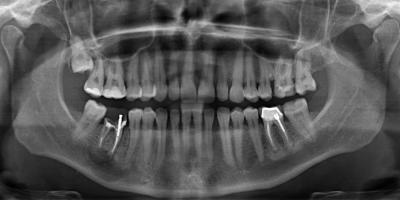 montre que les limites de la cavité osseuse sont plus étendues en fin d’intervention que celles de la lésion initiale car le curetage et la résection osseuse sont allés en tissu périphérique.
montre que les limites de la cavité osseuse sont plus étendues en fin d’intervention que celles de la lésion initiale car le curetage et la résection osseuse sont allés en tissu périphérique.
A 8 mois postopératoires, le CBCT montre sur plusieurs coupes (Fig. 22a, 22b, 22c)
u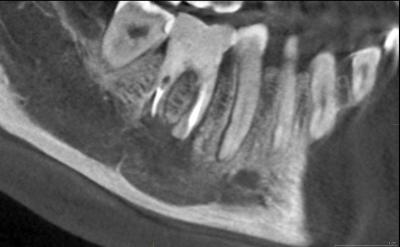
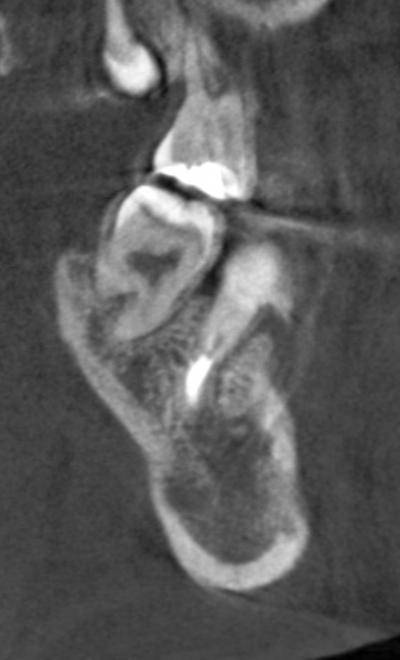 n aspect flou des bords de la cavité, signalant une cicatrisation osseuse en périphérie satisfaisante, avec une redifférenciation du canal mandibulaire dont la corticale avait disparu, soufflée par la lésion. La corticale externe au niveau de la fenêtre d’accès à la lésion est également en cours de reformation, si l’on compare aux coupes préopératoires (figures 13 et 14a,b).
n aspect flou des bords de la cavité, signalant une cicatrisation osseuse en périphérie satisfaisante, avec une redifférenciation du canal mandibulaire dont la corticale avait disparu, soufflée par la lésion. La corticale externe au niveau de la fenêtre d’accès à la lésion est également en cours de reformation, si l’on compare aux coupes préopératoires (figures 13 et 14a,b).
Les réflexions issues de ces cas cliniques permettent de proposer le protocole suivant de résection apicale, qui peut être entièrement laser assisté (Diode et Er-Yag) (Tableau 1).
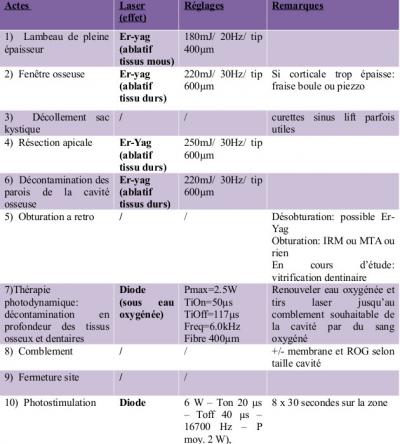
Perspective
La comparaison des résections osseuses au laser Er-Yag, à la fraise sur turbine et au laser CO2 montre meilleure cicatrisation des tissus osseux avec l’Er-Yag grâce à une néoformation osseuse significativement plus importante que dans les autres groupes (Pourzarandian et coll, 2004).
L’orientation actuelle des recherches concerne le scellement apical au laser Er-Yag après résection de l’apex. L’objectif est de provoquer une cristallisation de la surface dentinaire et une réduction de la perméabilité dentinaire. Les études sont en cours pour proposer des réglages optimum : 100mJ, 20hz, 2W pdt 15s environ sur une surface de 19m² sans eau (Arizu et coll, 2008). Des études complémentaires permettront de mieux définir les réglages efficaces en énergie et fréquence pour vitrifier la dentine et momifier les éventuelles bactéries résiduelles du domaine apical.
Conclusion
L’association de plusieurs longueurs d’onde laser pour la résection apicale offre plusieurs avantages : grâce à l’Erbium-Yag, une ostéotomie sans contact assure une coupe ciblée des tissus durs, sans carbonisation ni échauffement thermique grâce au spray de refroidissement. Il assure également une diminution de l’inconfort lié aux vibrations, moins de risque de contamination du site chirurgical par déplacement de couches de boue dentinaire et une amélioration des suites postopératoires. L’intérêt principal du laser Diode, qui n’a pas d’effet photoablatif sur les tissus durs, réside dans la possibilité de décontamination de tout le volume des tissus durs, le rayonnement laser Diode 980 nm pénétrant aussi profondément les tissus osseux et dentaires que les tissus gingivaux.
Espérons que la documentation systématique des cas complexes permettra d’établir un consensus sur les protocoles d’utilisation et sur l’intérêt, cliniquement très quantifiable, des technologies laser en odontologie.
Bibliographie
Cohen N., Roos T.
10 points clés en Endodontie : Chirurgie Endodontique, Indications et protocole chirurgical
http://www.alphaomega-alsace.com/
European Society of Endodontology
Quality guidelines for endodontic treatment: consensus report of the European Society of Endodontology.
Int Endod J. 2006 Dec; 39(12):921-30.
Gagliani MM, Gorni FG, Strohmenger L
Periapical resurgery versus periapical surgery: a 5-year longitudinal comparison.
Int Endod J. 2005 May; 38(5):320-7.
Lofthag-Hansen S, Huumonen S, Gröndahl K, Gröndahl HG
Limited cone-beam CT and intraoral radiography for the diagnosis of periapical pathology.
Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2007 Jan; 103(1):114-9.
Pourzarandian A, Watanabe H, Aoki A, Ichinose S, Sasaki KM, Nitta H, Ishikawa I.
Photomed Laser Surg. 2004 Aug;22(4):342-50.
Histological and TEM examination of early stages of bone healing after Er:YAG laser irradiation.
Rey G. et coll
Utilisation des lasers en endodontie. Editions CDP, Collection : JPIO. 2014
Rey G., Missika P
Les lasers et la chirurgie dentaire : Innovations et stratégies cliniques.
Editions CDP, Collection : JPIO. 2010
Von Arx T.
Saudi Dent J. Jan 2011; 23(1): 9–15.
Apical surgery: A review of current techniques and outcome