Traitement laser assisté des échecs en implantologie
 La pose d'implants dentaires est la solution la plus courante aujourd'hui et la plus appropriée du traitement des édentations. Il peut arriver, notamment dans le cas de péri-implantite, à savoir l'infection des tissus osseux péri-implantaire, que l'implant ne trouve plus sa stabilité et sa pérénnité. Le traitement par laser diode et erbium permet d'y remédier. Démontstration.
La pose d'implants dentaires est la solution la plus courante aujourd'hui et la plus appropriée du traitement des édentations. Il peut arriver, notamment dans le cas de péri-implantite, à savoir l'infection des tissus osseux péri-implantaire, que l'implant ne trouve plus sa stabilité et sa pérénnité. Le traitement par laser diode et erbium permet d'y remédier. Démontstration.
Pour consulter l'article en pdf, cliquez sur le lien en bas de page.
La pose d'implants est de plus en plus développée, et le taux de réussite de l'implantation
TRAITEMENT LASER-ASSISTE DES ECHECS EN IMPLANTOLOGIE
Parution LS 74, Juin 2017
GIANLUIGI CACCIANIGA 1)
JEAN LUC GIRARD2)
DAVIDE MACARIO13
1) University of Milano-Bicocca. Department of Medicine and Surgery. Milano, Italy.
Faculty of Medical Sciences, LUDES HEI Foundation, Malta,
VICE PRESIDENT I.M.L.A. (International Medical Laser Academy)
2) Lecturer in Certificate Laser Dentistry, University of Paris- Diderot, Paris, France and in University of Odontology of Montpellier, France.
PRESIDENT I.M.L.A. (International Medical Laser Academy)
3) University of Milano-Bicocca. Department of Surgery and Translational Medicine. Milano, Italy.
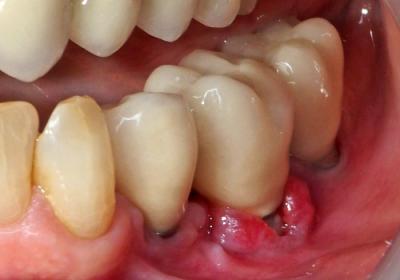
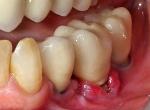
Fig. 1 : Péri-implantite sur Implant 36, 20 mois après pose .
Lire aussi sur le sujet :
La maintenance parodontale : acte essentiel aprés traitement des parodontites et peri implantites
Regénération osseuse assistée par laser
Simplicité et efficacité en hygiène bucco-dentaire
Place des lasers en Esthétique bucco dentaire quotidienne
Influence de l’utilisation d’un laser diode dans l’extraction des dents de sagesse incluses
Avulsion d'une racine fracturée en vue d'implantation assistée par laser
INTRODUCTION
La réhabilitation orale implanto-prothétique est aujourd’hui une réalité clinique et les implants dentaires, unanimement reconnus, tendent à prendre une part prépondérante dans le traitement des édentations. 30 ans de recherche clinique et expérimentale ont permis d’aboutir à une prédictibilité de résultats élevée mais, bien que les implants ostéo-intégrés offrent une alternative viable aux prothèses traditionnelles, ce type de réadaptation n’est pas sans complications.
En 1986 Albrektsson détermine les critères suivants de succès implantaires :
Un implant individuel, sans prothèse, est cliniquement immobile.
Les radiographies ne montrent aucune raréfaction osseuse autour de l’implant.
Résorption osseuse marginale < 1,5 mm durant la première année de mise en charge et <0,2 mm pour chaque année suivante.
Absence les signes et symptômes tels que : douleur, infection, atteinte du canal mandibulaire, paresthésie et neuropathie.
Avec de tels critères, les pourcentages de succès étaient de 85% à 5 ans après la pose, et de 80% à 10 ans.
Eu égard au nombre croissant d’implants posés, la péri-implantite, à savoir l’infection du tissu osseux péri-implantaire, représentera une pathologie en constante croissance d’observation. Il est ainsi évident que le traitement des maladies péri-implantaires constituera une part toujours plus importante de la future pratique dentaire. C’est précisément la raison pour laquelle trouver un traitement efficace qui garantisse la santé des tissus péri-implantaires durs et mous est fondamental pour prolonger la durée de vie de l’implant in situ.
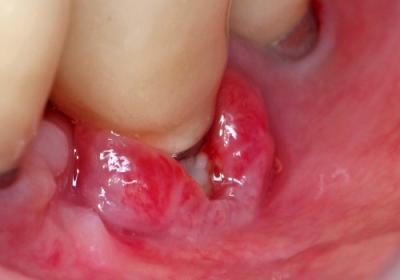
Fig. 2 : collet vestibulaire 36 à 20 mois.
SURFACE IMPLANTAIRE
Le titane est le matériaux majoritairement utilisé dans la chirurgie implantaire et est utilisé pur ou sous forme d’alliage. L’aluminium est ajouté pour augmenter la dureté du titane, réduire son poids spécifique et améliorer son module d’élasticité. Quand le titane est exposé à l’air, il se produit sur sa surface externe une fine couche d’oxyde de titane. Les oxydes que l’on retrouve sur la surface sont : monoxyde de titane (TiO), dioxyde (TiO2), trioxyde (TiO3) et des traces d’oxyde d’aluminium et de vanadium. La forme la plus stable, et majoritairement présente, est le TiO2 qui confère au titane une très haute résistance à la corrosion et qui est un des facteurs décisifs pour l’ostéo-intégration du titane et de ses alliages.
Pour améliorer la réponse du tissu osseux péri-implantaire, et pour réduire le temps de cicatrisation à l’interface os-titane, de nombreux traitements de surface ont été proposés. L’objectif unique étant de réussir à créer une liaison solide et durable entre tissu osseux et implant. La force de cette liaison devrait contribuer, entre autres facteurs, à la pérennité de l’attache du tissu minéralisé à l’implant.
Plusieurs types de surfaces implantaires ont été proposés au fil des ans, mais la rugosité de surface qui peut être considérée comme optimale n’a pas encore été définie avec certitude. Il semblerait, cependant, qu’une rugosité d’1,5 µm, puisse déterminer une meilleure réponse du tissu osseux péri-implantaire, que celle observée avec des surfaces de rugosité plus ou moins importante. Les surfaces de titane usinées ont été les premières utilisées. Elles ont une rugosité de 0,5-0,9 µm, constituée de rainures et de crêtes de petites dimensions. Ces surfaces présentent une densité inférieure en tissu osseux à leur interface par rapport à celles qui ont une plus grande rugosité.
Les surfaces de titane sablées sont traitées avec des particules de divers type (oxyde d’aluminium, Al2O3 ; dioxyde de titane, TiO2 ; hydroxyapatite, HA) et de diverses dimensions qui produisent une irrégularité de surface. Cela contribue à la modification du comportement biologique et biomécanique de l’implant. Les ostéoblastes tendent à se rapprocher et à adhérer aux surfaces sablées en commençant par déposer la matrice ostéoïde directement sur la surface de l’implant, dite « ostéogenèse de contact » ; la rugosité de surface influe sur la prolifération et la différenciation des cellules ostéoblastiques.
Le traitement des surfaces implantaires par mordançage à l’acide a été proposé afin d’éviter les inconvénients qu’il peut y avoir avec les processus de sablage.
Le processus « titane plasma-spray » consiste à recouvrir les implants à surface lisse avec de la poudre de titane. La technique utilise un four à arc à plasma. A l’intérieur, des particules de poudre de titane sont pulvérisées sous forme d’hydrure. Elles se décomposent dans le courant de plasma et les gouttelettes de métal ainsi formées sont « tirées » vers le corps de l’implant, à une distance de 15/20 cm. Ces particules de titane, de 50 à 100 µm de granulométrie, sont de cette façon soudées au corps implantaire, produisant une intéressante rugosité de surface tout en augmentant la superficie de contact de la structure. L’os nouvellement formé a été observé à l’intérieur des micro-irrégularités de la surface.
L’hydroxyapatite a également été utilisée pour recouvrir le titane afin d’améliorer l’ancrage os-implant. Les surfaces couvertes d’HA sembleraient améliorer la quantité et la qualité de l’os péri-implantaire.
Les surfaces nanostructurées : Les nanotechnologies peuvent être utilisées pour la modification des caractéristiques de surface des implants dentaires, tant en ce qui concerne la microstructure que la chimie de surface. Cela peut engendrer des modifications d’adhésion, de mobilité et d’orientation des diverses lignées cellulaires.
En 2008, Ong et al. dictèrent de nouveaux critères de succès implantaires :
Absence de mobilité
Absence de désagréments subjectifs persistants (douleur, sensation de corps étranger et/ou dysesthésie)
Absence d’infections péri-implantaires récurrentes avec suppuration.
Absence de radio-transparence autour des implants
Sondage péri-implantaires inférieur ou égal à 5mm (PPD ≤ 5 mm);
Absence de saignement au sondage (BOP-)
Perte osseuse inférieure à 1,5 mm la première année de mise en charge et à 0,1 mm par an (mésiale et distale)
La résorption de 1,5 mm après la première année de port est aujourd’hui considérée non plus comme une constante, mais une réponse liée à la formation de l’espace biologique, dans les cas où :
L’implant est inséré plus profondément.
Les tissus sont finsᶦ.
Présence de colonisation bactérienne dans le micro-gap (10 μm) fixture-abutment².
Les critères de réussite sont cependant distincts des critères de survie. On parle de survie lorsqu’un implant présente une perte d’os marginal supérieure à 2,5 mm, un sondage péri-implantaire > 5mm (avec BOP -/+) ou une récession de la marge muqueuse péri-implantaire, ce qui se traduit par la découverte marginale de l’implant, sans manifestations inflammatoires cliniquement évidentes, sans problèmes de type fonctionnel et esthétique, avec la pérennité de l’implant dans la bouche pour un nombre indéterminé d’années³.
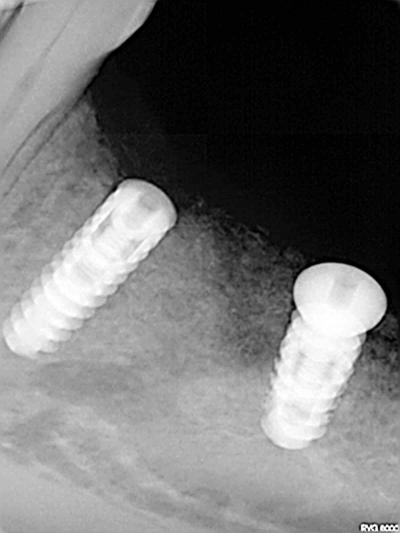
Fig. 3 : Implants 34 et 36 le jour de la pose avec greffe d’apposition crestale.
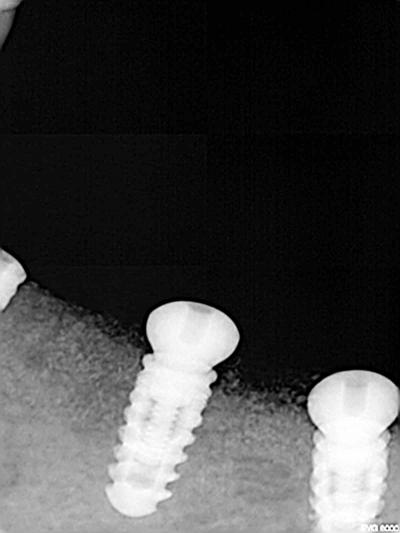
Fig. 4 : Implant 36 radiographiquement ostéo-intégré à 5 mois.
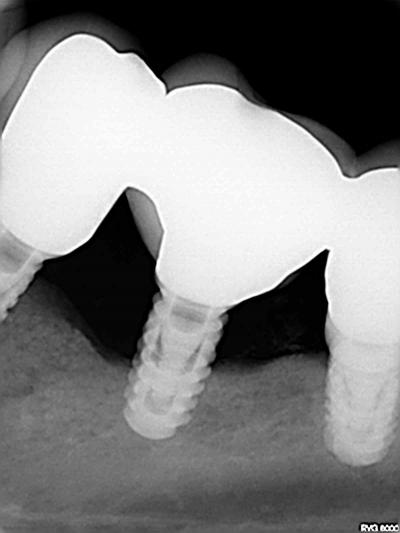
Fig. 5 : pertes osseuses de 4 mm sur 36 à 10 mois
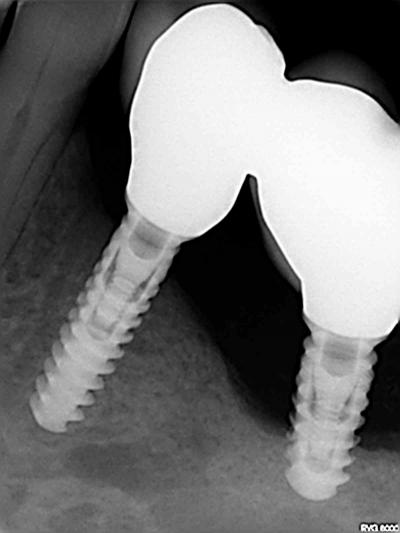
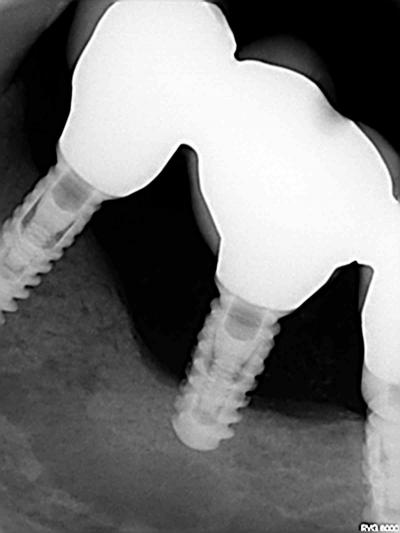
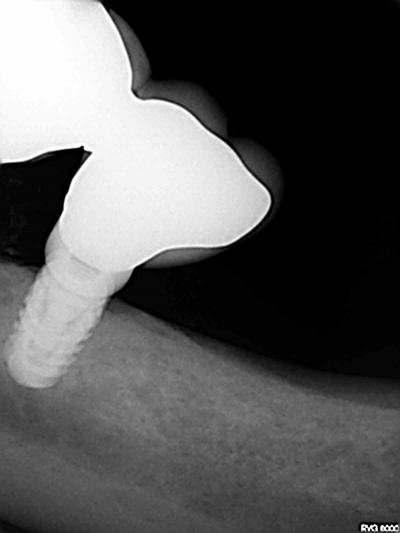
Fig. 6a, 6b, 6c : 34, 36 et 37, avec perte osseuse de 7 mm sur 36, à 20 mois.
L’echec implantaire existe sous deux formes : l’échec dit « précoce » et l’échec dit « tardif ». L’echec de l’implant précoce, dû au manque d’ostéo-intégration, peut s’expliquer par des facteurs non liés à la prédisposition à la parodontite, tel que la surchauffe de l’os >47°C durant la préparation du site implantaire, entrainant une nécrose osseuse péri-implantaire, une infection précoce, un manque de stabilité primaire ou une surcharge mécanique précoce.
L’échec implantaire tardif, survenant après l’ostéo-intégration, peut être de type biomécanique ou biologique. L’échec biomécanique se manifeste par une fracture de l’implant pouvant être liée à l’inadéquation/inadaptation de l’implant ou à une perte osseuse péri-implantaire qui se déplace vers l’apex implantaire où s’exercent les forces occlusales.
La perte osseuse péri-implantaire peut être liée à son tour à une péri-implantite ou, selon certains auteurs, à un mécanisme traumatique des forces occlusales en cas d'installation dans une position non axiale⁴.
L’échec biologique, lié à des agents bactériens, se manifeste par l'apparition de l'inflammation des muqueuses, nommée mucosite, ou par une perte des tissus durs, nommée péri-implantite. Les mécanismes pathogènes et les facteurs de risque sont très similaire, mais non identiques à la gingivite et à la parodontite⁵. Ils définissent la maladie péri-implantaire.
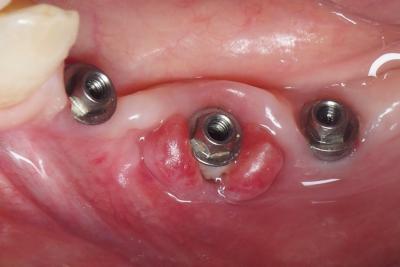
Fig. 7 : 34, 36, 37, après dépose du bridge trans-vissé à 20 mois.
LA MALADIE PERI-IMPLANTAIRE
Le terme « péri-implantite » a été introduit il y a plus de vingt ans pour représenter un état d’infection des tissus péri- implantaires⁶. Les inflammations péri-implantaires, nommées mucosites et les péri-implalntite , sont les principales complications biologiques implantaires impliquant respectivement 63,4 % et 18,8 % des patients en réadaptation implanto-prothétique⁷ . Le terme de mucosite péri-implantaire se réfère à une lésion inflammatoire de la muqueuse péri-implantaire avec rougeur, gonflement et saignement, sans perte de tissu osseux⁸.
La péri -implantite se caractérise, en plus de l'inflammation de la muqueuse péri-implantaire, par la perte osseuse (plus de 2 mm) et est capable de faire progresser à long terme la pathologie et conduire à la perte du système et à l'échec de la thérapie implanto-prothétique.
a. ASPECTS ANATOMIQUES : Différences structurelles entre des tissus mous parodontaux et des tissus mous péri-implantaires
La distinction fondamentale entre un implant et une racine dentaire, est l'absence du ligament parodontal typique de la dentition naturelle qui fait de l'implant une structure absolument rigide, ankylosée dans l'os. Le ligament parodontal, lui, absorbe le traumatisme de la charge occlusale jusqu'à un micron dans les trois plans de l’espace.
Au niveau où se termine apicalement l'épithélium sulculaire, présent dans les deux cas, débute le conjonctif supra- crestal. Celui-ci diffère non seulement de par la direction des fibres de collagène, perpendiculaires à la racine de la dent et solidement insérés dans le cément radiculaire, tandis qu'ils sont tangents à l’implant et créent une sorte de manchon avec des liaisons faibles sur le titane. Sa composition diffère aussi, avec une forte proportion de collagène dans le conjonctif péri-implantaire et une faible densité de fibroblastes qui le rende semblable à un tissu cicatriciel. D’où la vulnérabilité accrue des tissus mous péri-implantaires aux traumatismes et aux infections.
Dans les tissus parodontaux il y a des terminaisons nerveuses sensibles et un réseau vasculaire qui s’anastomose avec le réseau capillaire de la muqueuse superficielle. Dans le tissu péri-implantaire, l'absence de partie nerveuse le rend pratiquement insensible et le seul apport sanguin provient de la circulation osseuse périphérique. Autre point essentiel pour les tissus péri-implantaires supra-crestaux : leur proximité avec la connectique entre l’implant et le pilier. En présence de plaque ou de tartre aussi bien les tissus mous parodontaux que péri-implantaires manifestent, à un stade précoce, une gingivite ou une mucosite qui doit être le signal d’alarme des complications parodontales ou implantaires. Leur progression aura une vitesse exponentielle et destructrice dans les tissus péri-implantaires avec une résorption osseuse (péri-implantite), plus lente et progressive dans les tissus parodontaux (parodontite).
b. EPIDEMIOLOGIE
Zitmann et al. ont rapporté que l'incidence de l'évolution des péri-implantites chez les patients affectés par une maladie parodontale est près de six fois plus élevé que chez les patients qui ne disposent pas d'un passé d'inflammation parodontale. Au bout de 10 ans après leur pose 10% à 50% des implants dentaires ont montré des signes de péri-implantite.
Lors du "Sixth European Workshop in Periodontology," Lindhe et Meyle ont rapporté une incidence de mucosite supérieure à 80% et de péri-implantite entre 28% et 56%.
c. ETIOPATHOGENESE
Au cours des dernières années, de nombreuses expériences sur animal et études cliniques, ont défini l’accumulation de biofilm bactérien comme principal facteur étiologique dans le développement et la progression des infections péri-implantaires.
Par biolfilm, on entend une colonisation microbienne de surfaces de tout type. Après l'organisation des bactéries dans des biofilms, ceux-ci peuvent agir comme des organismes multicellulaires.
Outre les streptocoques, les fusobactéries (notamment Fusobacterium nucleatum), jouent un rôle important dans la première phase de la croissance bactérienne. Ils possèdent la capacité de se lier à tous les micro-organismes buccaux connus à ce jour.
Généralement, on peut affirmer que la formation du biofilm sous-gingival dépend de la rugosité de surface.
Dans certaines études, il a été trouvé, dans les poches péri-implantaires, des Staphylococcus aureus⁹ qui joueraient un rôle pathogénique importantᶦ⁰.
Après une période d'accumulation de plaque de 3 semaines les tissus mous parodontaux et péri-implantaires présentent tous deux un infiltrat inflammatoire tout à fait similaire de par sa composition, son volume et la distance qui le sépare de l'os.
d. FACTEURS DE RISQUE
Les patients ayant une mauvaise hygiène buccale présentent un risque plus élevé d'échec de l'implant (13,8%) , pour cause de péri-implantite, que les patients ayant une bonne/moyenne hygiène buccale (2,5/2,9%) ᶦᶦ
Outre l’accumulation des biofilms bactériens plusieurs facteurs de risque peuvent avoir des effets supplémentaires et affecter négativement la progression de la maladie.
Ces facteurs de risque sont le tabagisme, le diabète, les maladies systémiques, ostéoporose, ménopause, et leurs thérapies ( biphosphonates …), la radiothérapie, les facteurs génétiques, la surcharge occlusale, l'état de la muqueuse (il existe des preuves du fait qu'il est nécessaire d'avoir de la gencive kératinisée pour le maintien de la santé péri-implantaire), les facteurs locaux.
DIAGNOSTIC
a. DIAGNOSTIC DIFFERENTIEL
La mucosite présente une profondeur de sondage ≤ 4 mm (PD ≤ 4 mm), une rougeur, un gonflement, un saignement marginal (MBI), une douleur et un saignement au sondage (BOP +) tandis que la péri-implantite, en plus des symptômes inflammatoires communs avec la mucosite , inconstants de par ailleurs, présente, elle, une PD ≥ 5 mm, une résorption osseuse horizontale et verticale à l’examen radiographique , un BOP +, une suppuration, et, en phase terminale, une mobilité (Zitzmann et Berglundh 2008).
Une PD ≥ 5 mm (avec BOP) n’est cependant pas une condition suffisante en soit pour le diagnostic d’une péri-implantite, car des implants insérés plus profondément, par rapport à la crête osseuse, peuvent avoir un trajet trans-muqueux supérieur à la norme et présenter une profondeur de sondage ≥ 5 mm en l'absence de péri-implantite. C’est une perte osseuse ≥ 2 mm que donne la définition de péri-implantite.
La procédure primaire de diagnostic de la péri-implantite, comme de la maladie parodontale, est le sondage.
L'utilisation d'une sonde parodontale s’est avéré être très pratique, abstraction faite de l’imperfection des tests quant à leur reproductibilité de résultats ou à leur objectivité. De cette manière, on peut déterminer les paramètres cliniques suivants:
INDICE DE PLAQUE (PI)
INDICE DU SAIGNEMENT (BOP)
NOMBRE DE POINTS DE SAIGNEMENT
BOP = _________________________________
NOMBRE DE SURFACES TESTÉES
Un BOP + dans moins de 20% des sondages, répétés sur un même site péri-implantaire, représente un site sain dans 100% des casᶦ² ; donnée comparable à ce que l’on retrouve dans le cas des dentsᶦ³.
Inversement, si pour les dents un BOP est positif à plusieurs reprises, il représente un pronostic de progression de la parodontite de 30% (Lang et al., 1990 et 1996). Un BOP + dans plus de 50% des sondages répétées sur le même site péri-implantaire est un indice de certitude (100%) de la progression de la maladie péri-implantaireᶦ⁴. Un indice BOP élevé est donc lié à un état inflammatoire fort.
L'interprétation d'une augmentation de profondeur de sondage (PD) doit toujours être effectuée par rapport à une valeur déterminée directement avant la réhabilitation prothétique, afin de tenir compte de l‘implant et des facteurs spécifiques du positionnement implantaire.
Pour la détermination clinique on utilise les points suivants:
PD: Profondeur de sondage => distance entre la muqueuse marginale et le fond de la poche.
GR: Récession gingivale => distance entre l'épaulement de l'implant et de la muqueuse marginale
CAL: Niveau d'attache clinique => distance entre l'épaulement de l'implant et le fond de la poche
QUANTITÉ de production de liquide du sillon péri-implantaire
b. FORMATION DU PUS
De nombreuses études histologiques et immuno-histochimiques de biopsies de tissus péri-implantaires ont montré que l'infection est liée à une augmentation de l'infiltrat de cellules inflammatoires. Par conséquent, les infections péri-implantaires avancés sont associés cliniquement à la formation de pus. (Fig. 8)
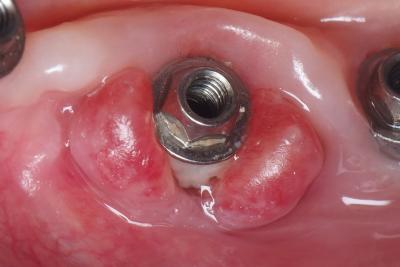
Fig. 8 : Suppuration 36 à 20 mois.
c. ÉVALUATION CLINIQUE DE LA MOBILITE IMPLANTAIRE
Même dans le cas de perte d'os péri-implantaire très avancée, causée par l'inflammation, l'ostéo-intégration résiduelle peut garantir un ancrage stable du corps de l'implant et de la superstructure associée. Contrairement à l’apparition progressive de la mobilité d’une dent, la moindre mobilité d’un implant doit être considérée comme une perte totale de l'ostéointégration. Ainsi, la présence clinique de mobilité implantaire n’est pas une méthode fiable d'évaluation.
d. DIAGNOSTIC RADIOGRAPHIQUE
Le diagnostic radiologique peut être considéré comme une méthode de routine pour l'évaluation du niveau de l'os marginal pour un implant ostéo-intégré. Il existe différents types de radiographie pour aider le clinicien dans le diagnostic de la péri-implantite.
RADIOGRAPHIE PANORAMIQUE
RADIOGRAPHIE RETRO-ALVEOLAIRE
SCANNER COUPES TOMOGRAPHIQUES
CONE BEAM COUPES TOMOGRAPHIQUES
APPROCHES THERAPEUTIQUES DE LA MALADIE PERI-IMPLANTAIRE
Les traitements actuellement recommandés pour le traitement de la péri-implantite sont principalement basées sur des preuves scientifiques résultant du traitement de la maladie parodontale. L'élimination du biofilm de la surface de l'implant est l'objectif principal dans le traitement de la maladie péri-implantaire.
a. DIRECTIVES CLINIQUES POUR LE TRAITEMENT DE LA PERI-IMPLANTITE
Résoudre le processus d'infection: enlever les dépôts mous et durs de la surface de l'implant
Adapter, le cas échéant, la superstructure prothétique, pour permettre l'hygiène bucco-dentaire optimale, qui est nécessaire pour la résolution du processus infectieux
Prévenir le rétablissement d'un processus infectieux par un renforcement des habitudes d'hygiène buccale du patient
Réaliser le traitement non chirurgical ou chirurgical pour améliorer l'accès nécessaire pour le nettoyage mécanique et chimique de la surface de l'implant (thérapie corrective)
Mettre en place des procédures régénératrices pour obtenir le remplissage du défaut et la réduction des poches dans les défauts intra-osseux (phase régénérative)
Produire des résultats grâce à la motivation du patient : l’hygiène bucco-dentaire du patient devrait être encouragée avec des suivis rigoureux (phase de support)
b. THÉRAPIE DE LA MUCOSITE
Pour le clinicien il est extrêmement important de diagnostiquer tôt et de traiter les lésions des implants non encore avancées. La thérapie mécanique, avec ou sans l'addition de bains de bouche antiseptiques a été trouvé utile dans le traitement de la mucosite péri-implantaire. Pour la décontamination par ultrasons des implants, des inserts ont été conçus avec des revêtements en plastique et téflon. Une bonne hygiène buccale et un programme d'entretien avec des évaluations régulières sur la profondeur de poche, soutenus par un nettoyage professionnel de l’implant, devraient faire partie intégrante de chaque séance de suivi post-opératoire consécutif à la pose d’un implant.
Des mesures d'hygiène bucco-dentaire peuvent être mise en œuvre avec des bains de bouche antiseptiques. Dans le cas de légère profondeur de sondage autour des implants, des bains de bouche à base d'huiles essentielles ou de Digluconate de Chlorhexidine peuvent être prescrits.
c. THÉRAPIE DE LA PERI-IMPLANTITE
Le traitement de la péri-implantite vise à arrêter la progression de la lésion (BOP-, ↓ PD) et, si possible, de reconstruire / ré-ostéo-intégrer l'os péri-implantaire perdu, grâce à l'élimination de l'infection bactérienne. Comme la péri-implantite est souvent associée à l'exposition des spires de l'implant, et que la surface implantaire est irrégulière, un abord chirurgical facilite souvent l’accès aux spires infectées, même s’il est toujours préférable de commencer par une approche non-chirurgicale, de façon similaire à ce qui se pratique pour la parodontite.
Le Protocole CIST, proposé par Lang et al.ᶦ⁵, est utilisé pour la maladie parodontale. Nous pouvons voir un schéma récapitulatif ci-dessous : (Fig. 9)
Paramètres Cliniques
CIST
VPI
BOP
PD mm
Défauts Rx
Sain
-
≤ 3 mm
-
A*
Mucosite
+
+
≤ 3 mm
-
A*
Sain ou Mucosite
4-5 mm
-
A+B*
Peri-Implantite
+
+
≥ 5 mm
≤ 2 mm
A+B+C+(D)*
Peri-Implantite
+
+
> 5 mm
> 2mm
A+B+C+D*
(*) A : Thérapie Mécanique B : Thérapie antiseptique C : Thérapie antibiotique D : Thérapie résectrice ou régénérative
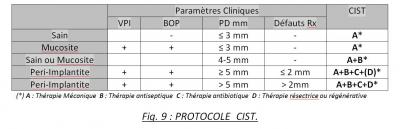
Fig. 9 : PROTOCOLE CIST.
d. LE TRAITEMENT NON CHIRURGICAL
1) THÉRAPIE MECANIQUE
Contrairement aux lésions parodontales qui peuvent toucher une seule face d'une dent, celles péri-implantaires ont généralement tendance à être circonférentielle. Le clinicien doit donc disposer d'outils qui permettent d'accéder à toute la surface implantaire touchée par la lésion.
2) THERAPIE ANTISEPTIQUE
Le traitement antiseptique et antibiotique topique doit être préféré dans les cas de péri-implantite, pour lesquels il est nécessaire d’avoir une plus grande concentration d'antiseptique ou d'antibiotique dans la poche. Il utilise des systèmes à libération lente (copeaux de chlorhexidine, microsphères de minocycline (Arestin) Polymères de doxycycline (Atridox))ᶦ⁶.
3) THERAPIE ANTIBIOTIQUE
Le traitement mécanique peut être associé à des antibiotiques à libération locales, comme des fibres imprégnées de tétracycline à libération lente et des gels contenant de la doxycycline (Atridox, Zila LNC., Fort Collins, CO, USA) ou des microsphères de minocycline (Arestin, OraPharma LNC., Horsham PA, USA).
4) THERAPIE AERO-ABRASIVE
Une nouvelle thérapie utilisée pour le contrôle de l'infection sous-gingivale est le Perio-Flow® (EMS, Nyon, Suisse), qui emploie des particules en suspension abrasive. Ce traitement, qui donne des résultats comparables à ceux du traitement des poches sous-gingivales, permet d'opérer en toute sécurité ᶦ⁷.
e. TRAITEMENT CHIRURGICAL
L’abord chirurgical est le traitement de choix pour la péri-implantite de par la complexité de la lésion et celle de la surface implantaire ᶦ⁸ compromise.
Le traitement non chirurgical de la péri-implantite est souvent insuffisant. Il constitue cependant un prérequis indispensable avant le recours à la chirurgie.
Le principal objectif de la chirurgie est de créer un accès pour le débridement et la décontamination de la surface de l'implant contaminé.
La décontamination avec un laser, l'utilisation de systèmes abrasifs ou l’implanto-plastie de la partie exposée de l’implant peuvent être considérée comme des techniques complémentaires à la chirurgie régénératrice ou ressectrice. Ils permettent d’atteindre des résultats sensiblement meilleurs par rapport à un traitement conventionnel seul.
La chirurgie osseuse peri-implantaire peut être une ressectrice, conservatrice ou régénératrice.
La chirurgie péri-implantaire ressectrice consiste en une ostéotomie du défaut infra-osseux pour supprimer la poche et aux meulages et polissages de la surface de l'implant exposée, qui n’est donc plus ostéo-intégrée, en utilisant des fraises diamantées et des cupules de caoutchouc pour le rendre similaire au col d'origine de l'implant.
La chirurgie conservatrice péri-implantaire utilise un lambeau d'accès qui permet l'élimination du tissu de granulation des parties infra-osseuse et supra-osseuse du défaut et le lissage de la surface exposée de l'implant située au-dessus de la limite osseuse.
La chirurgie régénérative péri-implantaire, qui suit les principes de la chirurgie parodontale, consiste en l’ablation du tissu de granulation présent dans les défauts supra-osseux et infra-osseux, ponçage de la surface exposée de l’implant et traitement de régénération des défauts infra-osseux péri-implantaire avec l'utilisation de greffes, membranes ou de greffes + membranes.
Selon les différentes situations cliniques, on peut opter pour une résection chirurgicale ou une régénération. En zone non-esthétique, la résection chirurgicale et le repositionnement apical peuvent être utilisés pour réduire la profondeur de sondage et améliorer l'accès à l'hygiène bucco-dentaire quotidienne. Le tableau suivant résume les facteurs clés : (fig. 10)

Fig. 10 : Facteurs déterminants.TRAITEMENT LASER ASSISTE
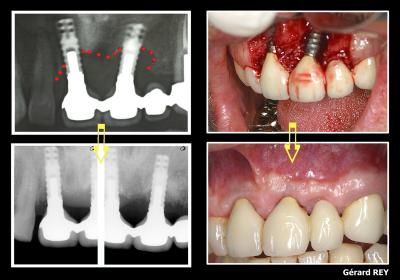
Fig.11 : Cicatrisation osseuse et gingivale après traitement de péri-implantite laser assisté. (Cas du Docteur Gérard Rey)
Chaque type de laser est caractérisé par la longueur d'onde spécifique et unique du rayonnement qu’il émet.
La lumière ordinaire est constituée d’un faisceau de rayons incohérents, de différentes longueurs d'onde, tandis que dans le faisceau laser chaque rayon émis a la même longueur d'onde et est constitué de photons en phase et cohérents.
La plupart des lasers médicaux ont leur longueur d’onde située dans le domaine du proche infrarouge, soit au-delà de 775 nm. Ils restent invisibles à l’œil humain capable de ne percevoir que la lumière située entre 375 à 775 nm.
Chaque longueur d’onde se trouve être diversement absorbée dans les divers constituants de la matière. Le choix de la longueur d'onde, et donc du laser, va être prépondérant selon les objectifs thérapeutiques et les tissus à traiter.
Les rayons laser Er: YAG ou CO2 sont fortement absorbés par l'eau et par l'hydroxyapatite. Leur pénétration dans les tissus mous ou osseux en contenant sera donc très faible (2 microns pour le laser Er: YAG, 20 microns pour le laser CO2). Leurs effets vont donc se concentrer en surface de ces tissus et ils ne seront donc pas capables de provoquer d’effet en profondeur.
Au contraire les rayons lasers Diode ou Nd: YAG, très peu absorbés par l’eau et l’hydroxyapatite vont pénétrer profondément dans les tissus mous ou osseux en contenant. Ils auront peu d’effets visibles en surface mais vont avoir des effets dans la profondeur des tissus. Ce sont précisément sur ces effets qu’est basée la thérapie au laser en parodontie.
Le rayon laser du Nd :YAP est considéré comme un laser pénétrant même si son absorption dans l’eau est largement supérieure à celle du Nd :YAG ou des lasers diode.
Le rayon laser Er: YAG très absorbée par l’eau et l'hydroxyapatite, pénètre peu dans la dent qui en contient beaucoup. Il permet d’obtenir un effet d'ablation sur les tissus durs, en utilisant l'eau pour enlever le tissu par des phénomènes d'explosion de molécules d'eau contenue in situ. Si le tissu est déshydraté l'action sera moins efficace.
A l’inverse, le rayon laser diode pénètre très profondément dans le tissu dentaire, jusqu'au niveau de la pulpe, qui peut recevoir des effets thermiques pouvant être nocifs pour les tissus. Ces effets devront être maitrisés pour éviter toute lésion profonde
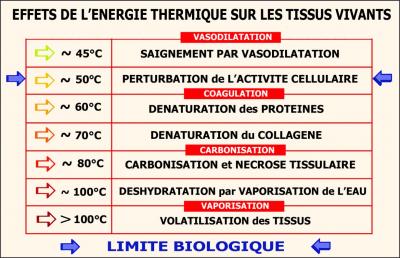
Fig. 12 : Effets de l’énergie thermique.
Ainsi on distinguera deux familles de laser : Les lasers pénétrants et les lasers absorbés.
Différences entre lasers absorbés et pénétrants sur les surfaces cibles:
Les deux types de laser ont des effets photo-ablatifs superficiels.
Les lasers absorbés peuvent avoir des effets thermiques mais ne peuvent atteindre la profondeur, ils n’ont pas de grands effets photo-dynamiques.
Les lasers pénétrants peuvent avoir des effets thermiques (fort, moyen, faible), photo-dynamiques (ou décontaminants) et des effets de bio-stimulation.
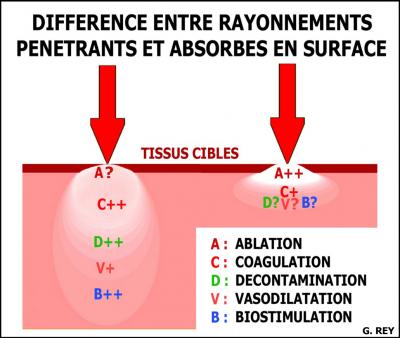
Fig. 13 : Différences d’effets des rayonnements .
En Parodontologie et en Implantologie le laser est utilisé pour deux aspects fondamentaux, dans les infections bactériennes:
L’effet décontaminant qui comprend deux types de réactions complémentaires :
a) des réactions photochimiques dont l’accepteur d’énergie est l’oxygène (activation d’une substance par rayonnement)
b) des réactions de photothérapie dynamique sans colorant (transformation de la matière sous l’effet d’une énergie lumineuse permettant des réactions de photo-oxydation et production d’oxygène singulet)
Historique des parutions : Rey G. 2000-2001) (Rey G, Caccianiga G. 2005-2008) (Caccianiga G, Rey G. 2007-2008)
L’effet Biostimulant détermine une sorte de "dopage biologique» pour les tissus touchés, favorisant leur régénération en cas de perte de substance.
Les effets biostimulants d’un rayonnement pénétrant atteignent des profondeurs supérieures aux effets décontaminants.
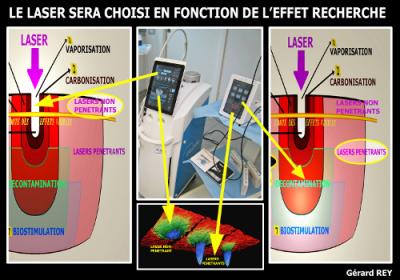
Fig. 14 : Choix du Laser selon l’effet recherché.
ETUDE : TRAITEMENT DES PERI-IMPLANTITES AVEC TECHNIQUE OHLLT
(Oxygen High Level Laser Therapy)
a. OBJECTIF
Quel est l'effet de la thérapie avec la technique OHLLT dans le traitement des patients atteints de péri-implantite, comme thérapie d'appoint pour traiter d’une façon non chirurgicale la maladie péri-implantaire ?
Serait-il possible de comparer la technique OHLLT à la thérapie conventionnelle (équipements à ultrasons ou manuelle) dans l'élimination des bactéries présentes dans les poches péri-implantaires?
Le but de cette étude est d'évaluer l'efficacité bactéricide d’un rayonnement laser de puissance élevée associé à l'utilisation de peroxyde d'hydrogène stabilisé contre les bactéries communément présentes dans les poches actives péri-implantaires.
b. MATÉRIEL ET MÉTHODES
1) Programme d'étude
Conception de l'étude: étude cas-témoin.
Durée de l'étude: 6 mois.
2) Critères d'inclusion de l'étude sur la population
• Sexe: masculin et féminin
• Age: 35 ans minimum
• Présence de parodontite chronique ou aiguë et de péri-implantite qui n'a pas subi de traitement parodontal chirurgical dans les 12 derniers mois dans le site affecté
• Chaque patient devra avoir des poches péri-implantaires > 4 mm avec saignement au sondage
• Le patient doit, après avoir été mis au courant de la nature du traitement auquel il sera soumis, signer le consentement éclairé.
3) Critères d'exclusion
• Patients qui ont démontré un manque de respect des protocoles.
• Patients séropositifs HIV.
• Patients atteints de sclérose en plaques.
• Patients souffrant d'une dépendance active ou passée à l'alcool ou la drogue.
• Patients ayant des problèmes psychiatriques ou émotionnels, car ils peuvent invalider le consentement éclairé ou ne pas être en mesure d'exécuter les instructions pour les manœuvres de soins à domicile.
c. TECHNOLOGIE OHLLT
La Technologie OHLLT (Oxygen High Level Laser Therapy) est un traitement qui comprend l'association d'un laser pénétrant avec une solution de H2O2 modifiée et stabilisée avec du glycérol-phosphate (dérivée de H2O2 à 10 volumes donc dépourvue d'actions cytotoxiques).
L'énergie du laser active la solution de H2O2 modifiée en libérant des radicaux libres d'oxygène singulet qui ont une activité antibactérienne sur les groupes Gram+ et Gram- spécifiques de la maladie parodontale. Le laser doit être capable de produire des pics de puissance de crête suffisamment élevés (2,5 W) pour être efficaces sur les germes tout en délivrant une puissance moyenne réduite (<0,8 watt) pour ne pas léser les tissus.
Les lasers diode sur le marché peuvent être de différents types selon leurs caractéristiques impulsionnelles:
Lasers utilisant une puissance élevée mais avec des périodes de repos longues pour ne pas causer des dommages thermiques.
Lasers qui utilisent une faible puissance avec des temps d'application prolongés et peu d’interruption.
Le premier type a un bon effet bactéricide mais un faible effet de biostimulant, le deuxième type a un bon effet biostimulant, mais un effet bactéricide inefficace.
Les logiciels des lasers diodes 980 nm utilisés dans la technologie OHLLT possèdent à la fois des pics de forte puissance (fondamentale pour éliminer les bactéries) et des temps d'application très court, de l'ordre de la microseconde, ce qui leur confère une puissance moyenne inférieure à 0,8 Watt (effet thermique réduit).
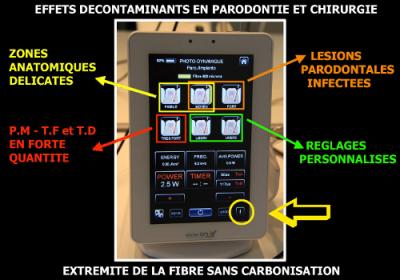
Fig. 15 : Choix d’un réglage Photo-Dynamique moyen. (Réglage Diode Wiser Icône)
Ce nouveau type de lasers diodes software-assistés permet de garantir la triade d'effets obtenus (vasodilatation, bon degré de décontamination et bio-stimulation), en étendant le Volume d'Efficacité Maximale (VEM) où se superposent ces effets recherchés à toute l’épaisseur des tissus cibles.
C’est ce que l’on doit chercher à obtenir chaque fois que nous irradions un tissu souffrant de maladie parodontale ou de péri-implantite.
Le OHLLT est caractérisé par:
Une puissance de crête élevée (2,5 watts): permettant la destruction des micro-organismes (effet décontaminant)
Une puissance moyenne réduite (0,5 à 0,8 watts) par des temps d’émission réduits: Pour diminuer les effets thermiques élevés (nocifs pour les tissus) et favoriser les effets thermiques légers (augmentation de la vasodilatation). Ceci augmente le flux sanguin vers le site traité, favorise la cicatrisation et la régénération (Augmentation de l’apport des facteurs de croissance, d'oxygène, de cellules inflammatoires et de cellules souches).
Une haute fréquence (10 000 Hz) activation et libération importante d'oxygène singulet (jusqu'à 10.000 fois par seconde), ce qui augmente l'activité antibactérienne
Une profondeur de pénétration maximale: avec la OHLLT on utilise un photo-sensibilisateur riche en oxygène mais transparent, non-chromophore, qui permet donc la pénétration du laser en profondeur.
L’élimination des composés d'argent de stabilisation de l’H2O2 remplacés par du glycérol-phosphate.
L'effet photochimique de cette thérapie photodynamique consiste en l’activation d'une substance (dans ce cas, du peroxyde d'hydrogène), par un rayonnement mono chromatique (un faisceau laser caractérisé par une seule longueur d'onde).
L'interaction entre la substance photo-sensibilisatrice et le faisceau laser produit des réactions photochimiques, dans lesquelles l'accepteur d'énergie est l'oxygène. Le peroxyde d'hydrogène stabilisé contient de l'oxygène et sa photo-activation permet une production d'oxygène singulet qui est un oxygène radicalaire (un radical libre est une espèce chimique hautement réactive qui a des électrons non appariés dans sa couche externe).
Découvert en 1924, l’oxygène singulet est 1000 fois plus actif que l’oxygène fondamental. Il est un intermédiaire universel dans les processus physiques, cliniques et biologiques des réactions moléculaires.
Ce liquide est, chez l’humain, un produit normal du métabolisme aérobique, il pénètre les membranes muqueuses et se décompose très rapidement en oxygène et en eau sous l’action des peroxydases des organismes vivants aérobies.
Des radicaux d'oxygène libres sont naturellement produits dans notre organisme: les PN neutrophiles stimulés par des anticorps libèrent de l'oxygène singulet qui détruit les cellules bactériennes par divers mécanismes :
Oxydation des membranes lipidiques des bactéries entraînant leur mort.
Dénaturation de l'ADN des micro-organismes
Destruction de leur membrane lysosomale
Modification de la fonction mitochondriale
Implosion de microbes à l'intérieur des poches
Cette PDT sous eau oxygénée est aujourd’hui très largement utilisée dans de nombreux domaines médicaux.
Le pouvoir décontaminant de cette PDT sans colorant a été découvert en Parodontologie et en Implantologie dans les années 90 et décrit pour la première fois en 2000 (Rey G 2000).
Les mécanismes de destruction des cellules infectieuses au cours de la thérapie photo-dynamique21 reprennent le même schéma d’action par la production d'oxygène singulet à partir des radicaux libres selon le principe :
Oxygénation des tissus obtenue par dépôt préalable de peroxyde d’hydrogène à 3 %.
Irradiation laser et interaction avec H2O2 contenue dans les tissus. L’eau oxygénée claire et incolore ne diminue pas la pénétration du rayonnement laser.
Libération de molécules d'H2O et d’O2 (oxygène fondamental ou dioxygène), à deux électrons non appariés sur orbites parallèles.
Nouvelle irradiation laser qui permet le passage d'un électron vers une orbite supérieure avec inversion de spin qui permet la libération d'oxygène singulet (O2 diamagnétique) qui comporte une double liaison entre les atomes d’oxygène (.O = O.).
La durée de vie de l’oxygène singulet dans nos tissus est de l’ordre de la microseconde avant que cette molécule, très réactive et très instable, s’isomérise en oxygène triplet (dioxygène paramagnétique) d’une durée de vie de l’ordre de la milliseconde.
Cet oxygène triplet redevient ensuite une molécule d’oxygène fondamental (dioxygène) disponible pour une nouvelle excitation22.
Cette brièveté d’existence est compensée par une fréquence très élevée des lasers Diodes utilisés (6000 Hz ou plus).
Réaction de l’oxygène singulet sur les bactéries provoquant leur destruction suivant les mécanismes pré-cités.
Le traitement de la péri-implantite va exploiter différents types d'action pour le contrôle de la plaque et du tartre:
Action mécanique (élimination du tartre avec des ultrasons et / ou curettes).
Action chimique (solution de povidone-iodée (Bétadine), véhiculée par ultrasons, en solutions diluées 1/5)
Action mécanique et chimique de l’aéro-polissage avec de la poudre de bicarbonate à haut pouvoir abrasif, dans le but d'une meilleure élimination des biofilms bactériens sur les surfaces des implants, tout particulièrement pour ceux nano-traités.
Action physique de la thérapie photo-dynamique: efficace pour éliminer même les bactéries les plus agressives.
La combinaison de ces trois phases de la thérapie nous permet une désinfection importante et à large spectre sur toute la surface de l'implant.
Une étude comparative des effets de laser seuls et en combinaison avec H2O2 est arrivée à ces résultats [8]:
Le peroxyde d'hydrogène utilisé seul produit peu d'effet sur l'élimination des micro-organismes.
Le peroxyde d'hydrogène seul est efficace seulement contre Prevotella intermedia et Aggregatibacter mais pas sur le reste des micro-organismes.
Le laser utilisé seul donne de mauvais résultats dans l'élimination des espèces bactériennes impliquées dans la maladie parodontale.
Le laser lui-même est seulement efficace sur Aggregatibacter.
Le laser en combinaison avec du peroxyde d'hydrogène présente une action antibactérienne beaucoup plus efficace sur la plupart des micro-organismes impliqués dans la maladie parodontale.
d. PROTOCOLE TECHNOLOGIE OHLLT POUR LE TRAITEMENT DE LA PERI-IMPLANTITE
Le protocole de Technologie OHLLT (décontamination laser + peroxyde d'hydrogène stabilisé) représente une solution alternative pour éliminer les bactéries dans les cas complexes les plus réfractaires aux thérapies conventionnelles.
Il existe deux types de traitement possibles : en aveugle et chirurgical.
Traitement non chirurgical: Prévu en cas de sondage avec une profondeur inférieure à 5 mm, (mucosite) et une perte de support osseux inférieure à 2 mm, ou de contre-indication / impossibilité d'effectuer un traitement chirurgical. (Fig 16 à 22)
Fig. 16 : Débridement Ultrasonore sous irrigation de Povidone Iodée à 20%.
Fig. 17 : Aéropolissage au bicarbonate de sodium à fort pouvoir abrasif .
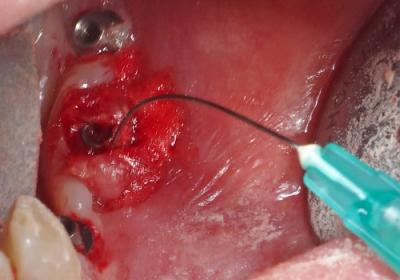
Fig. 18 : Irrigation au peroxyde d’hydrogène à 3% .
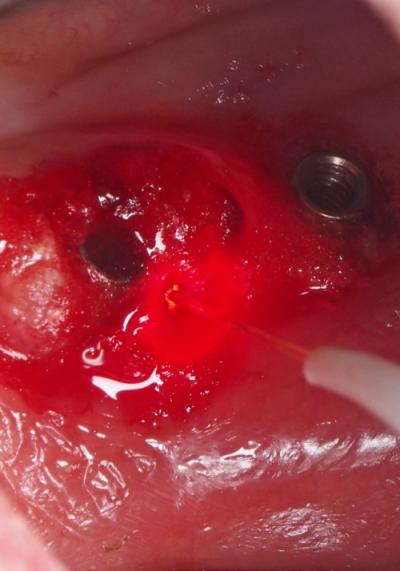
Fig. 19 : Traitement Photothérapie dynamique sans colorant au Laser Diode 980nm, fibre de 400µm, 2,5 W, 6000Hz, Ton 50 µs, Toff 117 µs, 75 J .
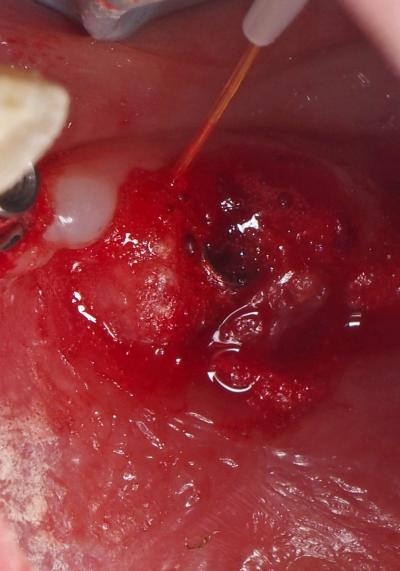
Fig. 20 : Coagulation au Laser Diode 980nm, fibre de 400µm, 2,5 W, 100Hz,
Ton 5ms, Toff 5ms, 25 J .
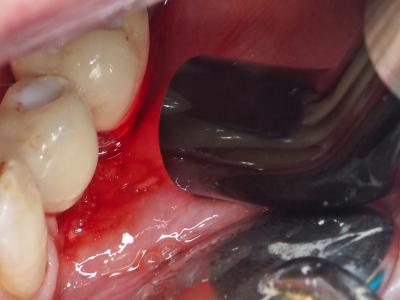
Fig. 21 : Biostimulation au Laser Diode 980nm, Lentille défocalisante coudée 2 W, 10000Hz, Ton 5µs, Toff 5µs, 150 J .
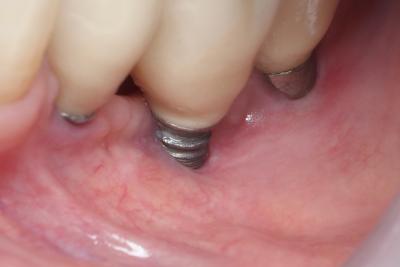
Fig. 22 : Cicatrisation 14 jours après traitement laser diode 980 nm non chirurgical. La situation clinique assainie va faciliter le traitement chirurgical de reconstruction .
Traitement chirurgical: Profondeur de sondage de plus de 5 mm et perte de support osseux égale ou supérieure à 2 mm.
e. PROTOCOLE D’ETUDE
Cette étude a été menée sur un groupe de dix personnes souffrant de maladie parodontale et péri-implantaire sans complications systémiques. Tous les patients ont subi le traitement des poches parodontales et péri-implantaires par la thérapie laser assistée décrite dans cet article. (Fig. 23-26 : Evolution radiologique d’une péri-implantite de 2008 à 2012).
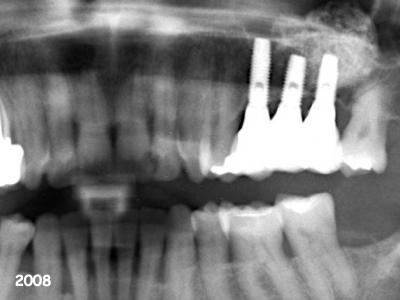
Fig. 23 : Implants en position 25-26-27 sans signe radiologique évident
de maladie péri-implantaire (2008).
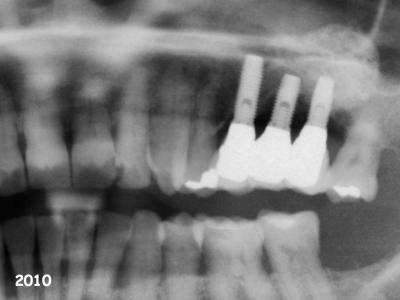
Fig. 24 : Implants en position 25-26-27
avec signe radiologique évident de début de maladie péri-implantaire (2010).
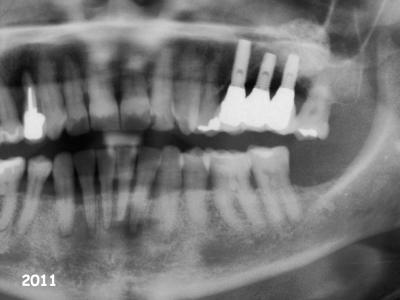
Fig. 25 : Implants en position 25-26-27
avec signes radiologiques importants de maladie péri-implantaire (2011).
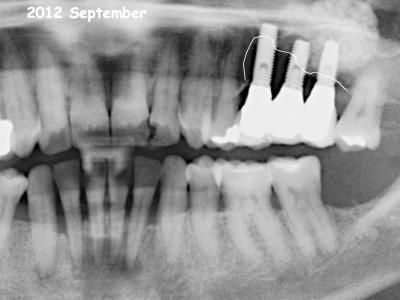
Fig. 26 : Implants en position 25-26-27 le jour du traitement chirurgical (2012)
f. SEQUENCES THERAPEUTIQUES
1° séance
• Obtenir le consentement éclairé.
• Collecte des antécédents médicaux.
• Contrôle des critères d'inclusion et d'exclusion de la technologie OHLLT
• Charting et sondage parodontal de toutes les poches et des récessions gingivales
• Indices de mesure de la plaque et de saignements
• Motivation du patient à l'achat et l'utilisation de tous les outils nécessaires pour le protocole de soins à domicile
• Prélèvement de fluide gingival, colonisé par des bactéries et contenant des cellules épithéliales, des poches péri-implantaires à traiter, par des pointes coniques de papier stériles, immédiatement envoyé au laboratoire pour analyse microbiologique.
• Exécution des radiographies rétro-alvéolaires immédiates et prescription d’analyse CBCT (éventuellement)
2° Séance (à 1 semaine de la première séance)
•Evaluation des données microbiologiques arrivée du laboratoire
•Anesthésie locale avec mépivacaïne et vasoconstricteur (épinéphrine 1: 200.000)
• Traitement parodontal non chirurgical complet de toute la cavité orale selon les techniques de parodontologie médicales laser-assistées (Application de povidone Iodée (Betadine) diluée à 1/5 concomitamment au débridement des poches parodontales et péri-implantaires par ultra-sons et curettes, aéro-polissage des surfaces radiculaires avec du bicarbonate de sodium en poudre à faible pouvoir abrasif ou avec de la poudre de glycine dans les poches parodontales, et avec de la poudre de bicarbonate de sodium à fort pouvoir abrasif dans les poches péri-implantaires. Irrigation des poches parodontales et péri-implantaires avec la solution de peroxyde d'hydrogène stabilisé, élimination de la solution en excès dans la cavité buccale par aspiration.
la solution de peroxyde d'hydrogène est laissée dans les défauts osseux pendant au moins 3 minutes de manière à permettre l'oxygénation des tissus durs et mous, puis introduction de la fibre du laser diode 980 nm dans les poches parodontales et péri-implantaires et traitement avec les réglages et les temps d’applications propres à la OHLLT (décrits plus loin)
• Programmation de la prochaine séance dans une semaine
3° Séance (à 1 semaine de la deuxième séance), (Fig. 27 à 30)
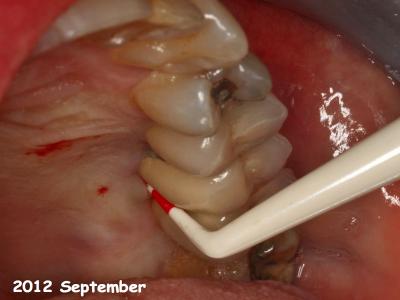
Fig.27 : Implants en position 25-26-27 évaluation clinique des défauts osseux
par sondage parodontal, le jour du traitement chirurgical(2012).
•Anesthésie avec articaïne et vasoconstricteur (épinéphrine 1: 200.000)
•Incision intrasulculaire et décolement d'un lambeau de pleine épaisseur en vestibulaire et en lingual/palatin s’étendant mésialement et distalement aux papilles des éléments adjacents à la lésion péri-implantaire à traiter
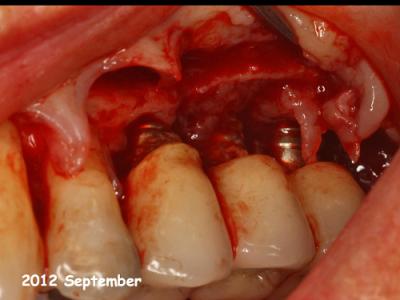
Fig. 28 : Implants en position 25-26-27 : vision chirurgicale des défauts osseux vestibulaires avant le traitement chirurgical.
• Débridement de la surface d'implant en utilisant des ultrasons sous irrigation de povidone iodée (Betadine) diluée à 1/5 et curettage du tissu de granulation à l’aide de curettes et pince gouge.
Curettage du tissus de granulation au laser Er :YAG.
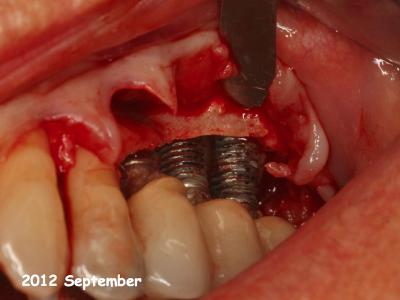
Fig. 29 : Implants en position 25-26-27 le jour du traitement chirurgical après l’élimination du tissu de granulation
au laser Er :YAG 180 mJ, 20 Hz, 70% H2O, (2012).
• Aéro-polissage de la surface implantaire avec du bicarbonate de sodium en poudre à haute abrasivité.
• Irrigation des défauts osseux péri-implantaires avec la solution de peroxyde d'hydrogène stabilisé
• Aspiration des excès de solution dans la cavité buccale.
• La solution de peroxyde est laissée en place dans les défauts osseux pendant au moins 3 minutes de manière à permettre l'oxygénation des tissus durs et mous.
• Introduction de la fibre du laser dans le défaut osseux
• Traitement laser diode 980 nm par technique OHLLT (réglage «décontamination»). La fluence du laser est liée au temps et à la puissance utilisée. La puissance laser moyenne est de 0,5 watts, Ton : 20 µs Toff : 80 µs, freq : 10KHz. Le diamètre de la fibre laser est de 400 microns qui correspondent à 0,0012 cm2. La fluence est donc 25 000 J / cm2.
Le laser est appliqué pendant 60 secondes sur la paroi vestibulaire et 60 secondes sur la paroi palatine/linguale avec un mouvement oscillant continu qui va de distal à mésial et vice-versa.
• Répéter le débridement de la surface avec Laser Er :YAG et / ou curettes et / ou ultrasons afin d'éliminer toute forme de plaque ou de tissu de granulation présent et répéter l’application de OHLLT pour obtenir un lit sanguin favorable à la régénération des tissus.
• Fermeture du lambeau par suture avec une soie de 4/0: un premier point de matelassier horizontal interne permet de bien rapprocher les deux volets sans créer de tensions puis sutures des marges occlusales des lambeaux.
Chez aucun patient il n’a été appliqué de matériau de comblement, laissant comme seul potentiel de régénération les tissus mous et durs.
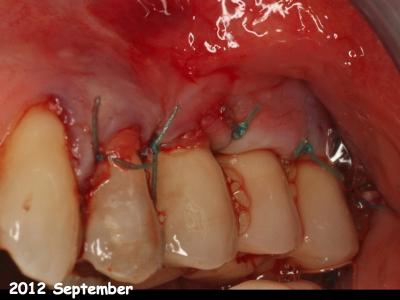
Fig. 30 : implants en position 25-26-27, le jour du traitement chirurgical
après fermeture du lambeau gingival (2012).
4° Séance (à 15 jours)
• Suppression des points et contrôle de la plaie
• Premier contrôle de traitement avec l'application de la thérapie photodynamique pour permettre une nouvelle décontamination. Si une zone n'a pas été traitée complètement, il est possible de répéter les ultrasons sous irrigation de povidone iodée (Betadine) sans recours à une nouvelle anesthésie.
• Suivi du traitement, tous les 20 jours, appliquer le peroxyde d'hydrogène modifié et stabilisé et le laser (réglages habituels : puissance moyenne : 0,5 Watt , puissance de crête : 2,5 Watts, fréquence : 10.000 Hertz, Ton :20 µs, Toff : 80 µs dans les défauts qui persistent, pour permettre une nouvelle décontamination plus une biostimulation. Si une zone n'a pas été traitée complètement, possibilité de reprendre le traitement ultrasonore sous irrigation de povidone iodée à nouveau. (fig. 31)
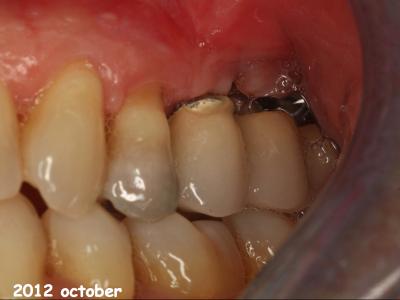
Fig. 31 : Implants en position 25-26-27 1 mois après le traitement chirurgical
• À 6 mois un prélèvement de fluide gingival est réalisé, avec des pointes de papier coniques, dans les poches péri-implantaires traitées et immédiatement envoyé au laboratoire pour analyse microbiologique.
Tous les paramètres cliniques (sondage, indice de plaque et indice de saignement) sont vérifiés.
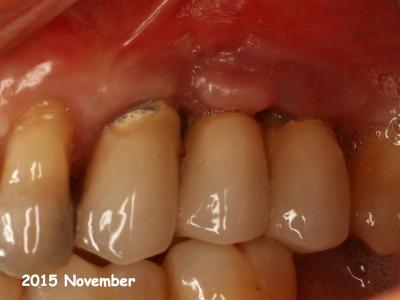
Fig. 32 : Implants en position 25-26-27 3 ans après le traitement chirurgical.
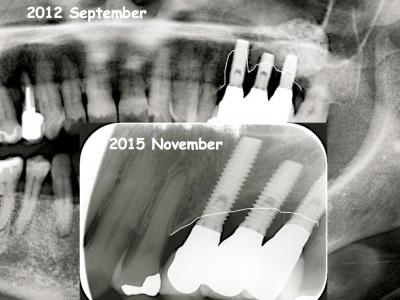
Fig. 33 : contrôle radiologique à 3 ans.
g. RÉSULTATS
Résumé des résultats:
L'indice de plaque a baissé en moyenne de 65% avec une fourchette qui va de 86% à 23%.
L'indice de Saignement a diminué en moyenne de 66% avec une fourchette qui va de 80% à 26%.
La profondeur de sondage moyen a chuté en moyenne de 1,6 mm avec une fourchette qui s’étend de 2,6 mm à 0,48 mm. (Fig. 34)
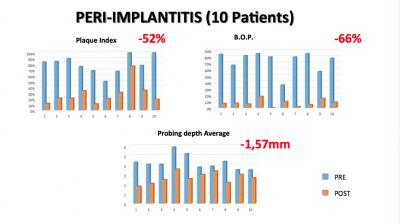
Fig. 34.
Ci-dessous sont répertoriés les résultats obtenus par analyses microbiologiques effectuées sur les échantillons (analyses bactérienne par PCR - Temps réel). Le premier prélèvement a été effectué avant le traitement et le second 6 mois après la fin du traitement.
Le Nombre de bactéries actinomycetemcomitans Aggregatibacter a baissé en moyenne de 98,70%. (Fig. 35)
Le Nombre de bactéries Porphyromonas gingivalis a baissé en moyenne de 89% avec une gamme qui va de 100% à 34,55%. (fig. 35)
Le Nombre de bactéries Tannerella forsythia a baissé en moyenne de 92% avec une gamme qui va de 100% à 47,73%. (fig. 35)
Le Nombre de bactéries Treponema Denticolas a diminué en moyenne de 88% avec une gamme qui va de 100% à 30,77%. (fig. 35)
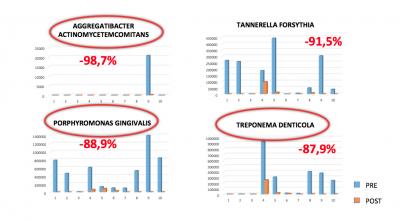
Fig. 35.
Les Nombre de bactéries de Fusobacterium nucleatum a chuté en moyenne de 85,68% avec une gamme qui va de 99,63% à 45,56%. (fig. 36)
Les Nombre de bactéries Campylobacter rectus de a diminué en moyenne de 89,64%, avec une gamme qui va de 100% à 62,84%. (fig. 36)
Le Nombre de bactéries Eikenella corrodens a augmenté en moyenne de 38,64%, avec une gamme qui va de -100% à 491,07%. (fig. 36)
Le Nombre de bactéries dans la charge totale a diminué en moyenne de 85,27% avec une gamme qui va de 99,36% à 42,03%. (fig. 36)
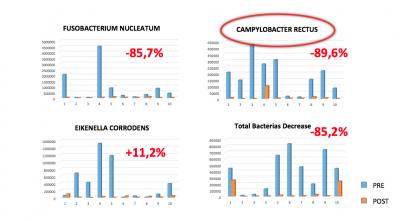
Fig. 36.
h. DISCUSSION
La majorité des méthodes de traitement des péri-implantites ont pour but de lutter contre la maladie par la réduction de la plaque bactérienne sur la surface des racines et des tissus péri-implantaires à des niveaux compatibles avec la capacité du système immunitaire de l'hôte à en contrôler la croissance.
Ces méthodes peuvent être avantageusement complétées par un traitement laser des surfaces implantaires visant à en éliminer la charge microbienne résiduelle.
Dans notre étude, nous pouvons mettre en évidence comment la thérapie photo-dynamique OHLLT utilisée comme adjuvant à la thérapie conventionnelle conduit à une diminution importante des souches bactériennes dans l’espace péri-implantaire.
Les résultats ci-dessus montrent une diminution significative de la charge bactérienne des sites touchés par la maladie sur lequel a été appliqué le protocole OHLLT.
On y constate notamment une diminution de la charge bactérienne totale d'environ 70% en raison de l'effet de décontamination de la OHLLT. On pourrait se référer aussi à l’effet bio-stimulant qui agit comme une sorte de dopage biologique avec une amélioration de l'indice de plaque proche de 70% , de l'indice de saignement de près de 75% et de la profondeur moyenne de sondage des sites touchés d'environ 1,2 mm.
Ce nouveau protocole pourrait résoudre le problème des péri-implantites réfractaires dans lesquelles les bactéries agressives, colonisatrices des sites péri-implantaires, peuvent être réduites dans une plus grande mesure que par tout autre type d'approche conventionnelle.
CONCLUSION
La majorité des études analysées montrent des effets bénéfiques modestes des lasers pulsés ( Er :YAG ou Er,Cr YSGG) par rapport aux thérapies conventionnelles (avec une instrumentation manuelle et /ou ultrasonore) dans le traitement initial des patients atteints de péri-implantite.
La thérapie photo-dynamique OHLLT, utilisant des lasers (diodes 980 nm) pénétrants et super-pulsés, grâce aux hypothèses biologiques qui la soutiennent, et par les résultats préliminaires obtenus avec cette étude, semble être un bon complément au traitement chirurgical de la péri-implantite.
L'efficacité du protocole proposé met en évidence la possibilité d'agir sur le site de la manière la moins traumatisante possible, mais avec une efficacité capable d’offrir une réelle amélioration de la condition de flore bactérienne.
La réduction de l'inflammation des tissus péri-implantaires, avec une diminution de la profondeur de sondage, du taux de saignement et une réduction massive de la charge bactérienne, tout particulièrement pour des souches agressives très souvent trouvés dans les sites touchés, réfractaires aux protocoles classiques, constituent des éléments tangibles quant à l'efficacité potentielle de ce protocole pour le traitement de la maladie péri-implantaire.
Il sera nécessaire de compléter cette étude pilote avec des RCT ou autres formes de recherche référencées dans la pyramide de preuves scientifiques en dentisterie.
BIBLIOGRAPHIE
1. Adel R, Lekholm U et al. A study of osseointegrated implants in the treatment of the edentulous jaws. International Journal of Oral Surgery 1981; 6:387-399
2. Albrektsson, T. & Isidor, F. Consensus report of session IV. In: Lang, N.P. & Karring, T., eds. Proceedings of the First European Workshop on Periodontology, 1994, pp. 365-369
3. Alsaadi et al. Impact of local and systemic factors on the incidence of late oral implant loss. Clinical Oral Implants Research, 2008; 19: 670-6.
4. Berglundh T, Lindhe J. Dimension of the periimplant mucosa. Biological width revisited. J Clin Periodontol. 1996 Oct;23(10):971-3.
5. Brägger U, Karoussis I, Persson R, Pjetursson B, Salvi G, Lang N. Technical and biological complications/failures with single crowns and fixed partial dentures on implants: a 10-year prospective cohort study. Clin Oral Implants Res. 2005 Jun;16(3):326-34.
6. Buser D, Martin W, Belser UC. Optimizing esthetics for implant restorations in the anterior maxilla: anatomic and surgical considerations. Int J Oral Maxillofac Implants. 2004;19 Suppl:43-61. Review.
7. Buser D. Titanium for dental applications: implants with roughened surfaces. In: Brunette DM, Tengvall P, Textor M
8. Caccianiga G, Rey G, Fumagalli T, Cambini A, Denotti G, Giacomello MS. Photodynamic therapy (association diode laser/hydrogen peroxide): evaluation of bactericidal effects on periodontopathic bacteria: an in vitro study. European Journal of Infiammation 2012
9. Caccianiga G, Baldini A, Baldoni M, Tredici G. Application of laser in periodontology: microbiological evaluation with PCR-Real Time. Mediterranean Dental Implant Congress 2004
10. Caccianiga G,Rey G., Paiusco A, Fumagalli T, Cambini A, Giacomello MS. The use of laser diodes superpulses in implantology. European Journal of Infiammation 2012
11. Caccianiga G, Urso E, Monguzzi R, Gallo K, Rey G. Efecto bactericida del laser de diodo en periodoncia. Av periodon implantol 2007
12. Ericsson I, Berglundh T, Marinello C, Liljenberg B, Lindhe J. Long-standing plaque and gingivitis at implants and teeth in the dog. Clin Oral Implants Res. 1992 Sep;3(3):99-103.
13. Ericsson I, Persson LG, Berglundh T, Marinello CP, Lindhe J, Klinge B. Different types of inflammatory reactions in peri-implant soft tissues. J Clin Periodontol. 1995 Mar;22(3):255-61.
14. Etter TH, Håkanson I, Lang NP, Trejo PM, Caffesse RG. Healing after standardized clinical probing of the perlimplant soft tissue seal: a histomorphometric study in dogs. Clin Oral Implants Res. 2002 Dec;13(6):571-80.
15. Evans CD, Chen ST. Esthetic outcomes of immediate implant placements. Clin Oral Implants Res. 2008 Jan;19(1):73-80.
16. Evian CI, Emling R, Rosenberg ES, Waasdorp JA, Halpern W, Shah S, Garcia M. Retrospective analysis of implant survival and the influence of periodontal disease and immediate placement on long-term results. Int J Oral Maxillofac Implants. 2004 May-Jun;19 (3):393-8.
17. Felo A, Shibly O, Ciancio SG, Lauciello FR, Ho A. Effects of subgingival chlorhexidine irrigation on peri-implant maintenance. Am J Dent. 1997 Apr;10(2):107-10.
18. Feloutzis A, Lang NP, Tonetti MS, Bürgin W, Brägger U, Buser D, Duff GW, Kornman KS. IL-1 gene polymorphism and smoking as risk factors for peri-implant bone loss in a well-maintained population. Clin Oral Implants Res. 2003 Feb;14(1):10-7.
19. Ferreira SD, Silva GL, Cortelli JR, Costa JE, Costa FO. Prevalence and risk variables for peri-implant disease in Brazilian subjects. J Clin Periodontol. 2006 Dec;33(12):929-35.
20. Fransson C, Wennström J, Tomasi C, Berglundh T. Extent of peri-implantitis- associated bone loss. J Clin Periodontol. 2009 Apr;36(4):357-63
21. Rey G. L'apport du laser dans les parodontites et les péri implantites. La lettre de la stomatologie 2001 ; avril : 6-9
22. Rey G, Régénération osseuse laser assistée : proposition pour un protocole reproductible. La Lettre de la Stomatologie . 2015 Dec ;68 : 6-26.
23. Wilkinson F, Helman WP, Ross AB. Rate constants for the decay and reactions of the lowest electronically excited singlet state of molecular oxygen in solution. J Phys Chem Ref 1995; 24 : 663-679.