Le Mécanisme biochimique de la "PDT sans colorant"
 L'utilisation de lasers comme une thérapie alternative ou en adjonction démontre un effet positif dans le traitement de la maladie parodontale, et l'énergie photonique des lasers peut améliorer le résultat
L'utilisation de lasers comme une thérapie alternative ou en adjonction démontre un effet positif dans le traitement de la maladie parodontale, et l'énergie photonique des lasers peut améliorer le résultat
Auteur : Dr Bilel Maraoui (Tunisie)
Docteur en Médecine Dentaire
diplôme post-universitaire en implantologie
master en science en dentisterie laser assistée
Professur attaché à l'université de Gênes
Enseignant visiteur à l'université de Montpellier
Introduction :
Le biofilm bactérien a été considéré comme le principal facteur de la présence ou de la progression de la maladie parodontale (1). Les principales espèces présentes dans le biofilm de la parodontite sont : Fusobacterieum Nucleatum, Peptostreptococcus Micros, Prevotella Intermedia, Tannerella Forsythia, Porphyromonas Gingivalis, Treponema Denticola et Aggregatibacter Actinomycetemcomitans (2).
L’objectif principal du traitement parodontal est de contrôler cette infection en réduisant ou en éradiquant les espèces bactériennes à l'intérieur de la poche et de restaurer un environnement pour la cicatrisation des tissus environnants.
Plusieurs thérapies ont été proposées pour traiter la maladie parodontale en phase initiale. Le détartrage et le surfaçage radiculaire (DSR) sont considérés comme le « Gold Standard », bien que cette procédure puisse paraître simple, son application peut entraîner des échecs (3-7). La prescription complémentaire d'antibiotiques locaux ou généraux, en adjonction au DSR, a été proposée et a permis une légère amélioration des résultats avec des limitations dues à de nombreuses résistances bactériennes et au pouvoir pénétrant de ces pathogènes (8).
L'utilisation de lasers comme une thérapie alternative ou en adjonction démontre un effet positif dans le traitement de la maladie parodontale, et l'énergie photonique des lasers peut améliorer le résultat (9).
Les dispositifs lasers peuvent être utilisés seuls ou en complément au DSR, avec ou sans photosensibilisateur dans le cas d'une thérapie photodynamique, au cours de procédures chirurgicales et non chirurgicales. Les lasers en thérapie parodontale se sont avérés bénéfiques pour le contrôle de la bactériémie, une meilleure élimination de l'épithélium enflammé dans les poches, l'élimination efficace du calcul sous-gingival (à l'aide de lasers à erbium) et l'amélioration de la régénération parodontale chez les animaux et les humains, sans endommager les tissus osseux et pulpaires environnants.
Parmi les lasers utilisés en thérapie parodontale, le lasers diode, utilisé principalement en complément au DSR, a montré une capacité de réduction des bactéries parodontales pigmentées (10), et réduire la charge bactérienne grâce à son effet photothermique (11-17), qui peut, en revanche, causer des dommages collatéraux irréversibles aux tissus environnants (18).
La thérapie photodynamique antimicrobienne (aPDT) a été proposée par la suite comme complément au DSR et dont le principe repose sur un ciblage des bactéries de manière sélective sans endommager les tissus voisins par l'utilisation d'un photosensibilisateur qui sera activé avec une longueur d'onde spécifique. Cependant, les études ont rapporté des résultats controversées (19-24).
Parmi ces thérapies, un protocole a été établi par Gérard REY, utilisant du peroxyde d'hydrogène à une concentration de 3% à l'intérieur de la poche parodontale, et irradié par un laser pénétrant (des longueurs d'onde comprises entre 810 nm et 1064 nm ont été utilisées pour ses études expérimentales) (25) en complément au DSR, pour éliminer avec efficacité le biofilm et augmenter le taux de réussite du traitement parodontal. G. Rey a nommé son protocole la thérapie photodynamique sans colorant "PDT sans colorant" et a suggéré que la réaction entre le peroxyde d'hydrogène, le laser et le sang à l'intérieur de la poche créera l'oxygène singulet qui a un effet bactéricide hautement élevé. Cette « PDT sans colorant » a été testé par le professeur Rey depuis le début des années 90. Elle a fait l’objet de nombreuses vérifications, in vivo et in vitro, au début des années 2000 et qui ont toutes validées l’effet décontaminant et la supériorité de ce protocole par rapport aux autres traitements. Ce protocole est testé dans des départements de dermatologie et d’infectiologie, en France et en Italie.
Le but de cet article est d’expliquer le mécanisme photochimique de la « PDT sans colorant » proposé par Gérard REY et de la comparer à la thérapie photodynamique classique.
Les transitions électroniques d’une molécule :
Selon la première loi de la thermodynamique, lorsque l'énergie photonique est absorbée par le tissu au moyen des chromophores, elle est conservée, transformée ou libérée à d’autres molécules, et trois possibilités de transitions peuvent être mises en évidence (fig. 1) :
- La première est la voie prédominante produite lorsque l'énergie est absorbée par les chromophores correspondants est appelée conversion interne. Durant cette réaction, les chromophores absorbent l'énergie photonique incidente, puis ces molécules sont dans un état excité et cela entraîne une augmentation de la relaxation vibratoire des liaisons intermoléculaires, ce qui va engendrer la transformation de l’énergie photonique en énergie thermique.
L'absorption par les chromophores tissulaires des rayons incidents donnant lieu à une dénaturation des protéines et évaporation de l'eau interstitielle, ce mécanisme induit une ablation du tissu cible par un effet photothermique appelé photothermolyse.
- La deuxième possibilité de transition, est lorsque l'énergie absorbée par le tissu cible n'est pas aussi important pour atteindre le niveau d'ablation, c’est la fluorescence qui est la réémission de lumière avec une longueur d'onde plus longue. Ce type d'interaction est très utile dans la détection des caries et les techniques tomographiques pour balayage des tissus mous au cours d’un changement néoplasique.
- La troisième voie est appelée photochimique. Dans ce cas, l'énergie absorbée est en mesure de faire passer l'état des molécules au premier état singulet, ou excité, et par la suite un relâchement d’énergie aboutit à un état triplet du chromophore (inter-crossing system). Cet état permet des réactions telles que le transfert d'énergie vers une autre molécule à l'état fondamental comme l'oxygène, pour former des espèces très réactives appelées oxygène singulet.
Ce type de molécule a un effet bactéricide très important qui peut provoquer un stress oxydatif aux cellules bactériennes et par la suite l'apoptose. Un tel mécanisme est observé spécialement dans le cas des thérapies photodynamique où un photosensibilisateur est utilisé pour transférer l'énergie aux molécules d'oxygène à proximité
En plus de la réaction photochimique, une deuxième réaction peut se produire lorsque les photons, ayant des longueurs d’onde entre 600nm et 1200nm, sont absorbés par les mitochondries des cellules exactement dans l'unité 4 de la chaîne respiratoire mitochondriale, connue sous le nom de cytochrome c oxydase.
Une telle action induit une augmentation du pH cellulaire et de la production d'ATP, qui provoque un effet photobiologique communément appelé photobiomodulation.
Fig. 1 : Le Diagramme de Jablonski de transition électronique
La thérapie photodynamique (aPDT)
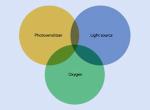
La thérapie photodynamique ou thérapie photochimique est un traitement basé sur l’activation d'un agent photosensible retenu préférentiellement par les cellules et les tissus. L'activation de ce photosensibilisateur conduit à la formation d'espèces d'oxygène hautement réactives telles que l’oxygène singulet, ces espèces réactives permettent d'éliminer les pathogènes. Le mode d’action de la thérapie photodynamique repose sur trois facteurs principaux : le photosensibilisateur, la lumière d'une certaine longueur d'onde et la présence d'oxygène à l'intérieur du tissu (fig. 2).
Fig 2 : Les principaux éléments de la aPDT
Le premier facteur de réussite d'une thérapie photodynamique est le choix du photosensibilisateur, composé chimique qui, lorsqu'il est activé par une longueur d'onde spécifique, forme une espèce d'oxygène hautement réactive qui entraînera la mort des cellules.
Il est important de souligner que la majorité des photosensibilisateurs sont représentés par une catégorie importante appelée PORPHYRINES. Celles-ci sont trouvées dans tous les organismes vivants, qu'ils soient animaux ou végétaux. Ils se situent principalement dans les cellules et les organes responsables de la production, du métabolisme et du transport de l'énergie.
Les photosensibilisateurs les plus applicables en dentisterie pour les procédures antimicrobiennes sont : le Bleu de Toluidine O (excité avec la longueur d'onde 635 nm), le Bleu de Méthylène (excité avec la longueur d'onde 660 nm) et la Curcumine (excité avec une longueur d'onde comprise entre 300 et 500 nm).
Le deuxième facteur de réussite de la thérapie photodynamique est l'utilisation d'une source lumineuse spécifique. Cela doit coïncider avec l'absorption maximale du photosensibilisateur utilisé.
La monochromaticité et la cohérence de la lumière laser les rendent supérieures aux autres sources de lumières, ce qui permet au laser d'interagir avec le photosensibilisateur sans créer l’échauffement des tissus. En dentisterie, les appareils laser les plus utilisés pour la aPDT se situent entre 600 et 810 nm. La photo-oxydation est le processus de base de l'effet de thérapie photodynamique, composé de nombreuses réactions chimiques et biologiques.
En 1976, Weishaupt et son équipe ont postulé que l'oxygène singulet (1O2) est l'agent cytotoxique responsable de la photoinactivation des cellules tumorales.
La photo-oxydation peut être divisée en deux étapes fondamentales (fig. 3) :
1. Passage du photosensibilisateur de l'état fondamental S0 à l'état triplet T1 : la molécule photoréactive est initialement à l’état fondamental S0. Suite à l'absorption d'un photon, elle se retrouve à un niveau énergétique supérieur de type singulet S1. Une conversion inter-système entre l'état singulet S1 et le l'état triplet T1 est alors possible bien que cette transition non radiative soit interdite : Le photosensibilisateur est à l'état triplet T1 et peut, par la suite, participer à la deuxième étape de la réaction de photo-oxydation.
hv CIS
Sens (S0) → Sens * (S1) → Sens * (T1)
Il faut rappeler qu'à l'état singulet S1, la conversion inter-système S1 → T1 n'est pas le seul type de transition effectué : par exemple, les phénomènes de fluorescence peuvent être observé. Pour que l'effet photodynamique soit significatif, il est nécessaire que l'efficacité de la conversion inter-système S1 → T1 du photosensibilisateur soit nettement supérieure à l'efficacité des autres processus de désactivation S1.
2. Photo-oxydation à partir de l'état Triplet (T1) du photosensibilisateur : La molécule à l'état de triplet (T1) est un agent très réactif qui peut réagir non seulement avec les molécules du tissu où se concentre le photosensibilisateur, mais aussi avec l'oxygène présent à ce niveau et fourni par le système vasculaire. Il existe donc deux types de réactions durant cette étape :
- Réaction de type I : le photosensibilisateur réagit directement avec la molécule d'un substrat réducteur : la réaction de type I est donc un transfert d'un hydrogène ou d'un électron de ces substrats réducteurs vers la molécule photosensibilisante à l'état triplet T1. En conséquence, les radicaux ou des ions radicaux sont produits.
Sens * (T1) + RH → SensH ° + R ° (transfert d'hydrogène)
Sens * (T1) + RH → Sens- ° + RH + ° (transfert d'électrons)
Les radicaux SensH ° et les formes semi-réduites Sens- ° peuvent alors réagir, soit avec d'autres molécules RH du substrat, soit avec l'oxygène molécules à l'état de triplet fondamental. La réaction avec l’oxygène ne produit pas seulement des agents oxydants très puissants (anion superoxyde, hydroperoxyde) mais aussi régénére le photosensibilisateur dans son état fondamental.
SensH ° + 3O2 → Sens + HO2
Sens- ° + 3O2 → Sens + O2- °
- Réaction de type II : le photosensibilisateur à l'état triplet Sens (T1) transmet son énergie à une molécule d'oxygène qui passe de l'état fondamental 3O2 à l'état excité 1O2.
Sens * (T1) +3O2 → Sens +1O2
Fig. 3 : Les mécanismes de la thérapie photodynamique aPDT
L'oxygène singulet formé 1O2 va interagir avec diverses molécules organiques riches en électrons ; celles-ci vont s'oxyder et entraîner une altération de l'intégrité des organites de la cellule tels que la membrane plasmique, les mitochondries, les lysosomes, le noyau, et par la suite provoquer la nécrose des cellules bactériennes.
La thérapie photodynamique a été développée en tant que méthode non invasive utilisant de faibles paramètres pour surmonter les dommages thermiques qui peuvent être irréversibles dans le tissu parodontal environnant. Dans cette technique, les bactéries sont ciblées de manière sélective sans endommager les tissus. De nombreux articles ont étudié l'efficacité de la thérapie photodynamique dans le traitement de la maladie parodontale et la décontamination en général, mais les résultats sont toujours controversés.
Marta Segarra-Vidal et Al. (26) en 2017, ont évalué les effets de la thérapie photodynamique au cours du traitement non chirurgical de la parodontite chronique. Ils ont effectué une étude clinique randomisée, où ils ont choisi 60 patients, répartis en 3 groupes (20 patients chaque groupe).
Le premier groupe a servi de groupe témoin avec des patients en bonne santé parodontale.
Le deuxième groupe a reçu un traitement avec la méthode conventionnelle avec détartrage et surfaçage radiculaire.
Le troisième groupe de patients a reçu le même traitement mais avec une thérapie photodynamique rajoutée.
Tous les paramètres cliniques, microbiologiques et biochimiques ont été enregistrés avant, pendant et après le traitement. Le laser utilisé dans cette étude est un laser diode de 670 nm,
(puissance :150 mw - 60 secondes dans chaque poche parodontale). Le photosensibilisateur est un bleu de méthylène à une concentration de 0,005%.
La procédure est appliquée la première semaine, à 5 semaines et à 13 semaines. Ils ont conclu que la thérapie photodynamique n'apporte pas d'avantages supplémentaires en termes de paramètres cliniques par rapport au DSR seul. La thérapie photodynamique réduit uniquement la quantité d'actinomycetemcomitens. Selon cette étude, la aPDT en adjonction au DSR n'a entraîné aucune amélioration supplémentaire par rapport au DSR seul.
Mohammad Berakdar et Al. (27) en 2012, ont comparé l'effet supplémentaire de la aPDT au DSR seul, chez les patients atteints de parodontite chronique.
20 patients sont inscrits dans cette étude avec pour chacun, 4 dents avec une profondeur de sondage de plus de 5 mm. Tous les paramètres cliniques sont enregistrés, avant la thérapie, à un mois, trois et six mois après le traitement. Le détartrage et le surfaçage radiculaire sont réalisés chez tous les patients avec des instruments manuels.
Les dents du groupe test ont reçu un traitement supplémentaire de la thérapie photodynamique. Le photosensibilisateur utilisé est un Bleu de méthylène à 0,005% et activé avec un laser diode de 670 nm avec une puissance maximale de 150 mW pour 60 secondes. Ils ont conclu que la thérapie photodynamique en complément du DSR peut être recommandée comme option traitement adjuvant, avec une légère amélioration clinique observée par rapport au détartrage et surfaçage radiculaire seul.
Pourajiabgher et Al. (28), en 2016, ont étudié, dans une étude in vitro, différentes concentrations et différents temps d'irradiation de deux photosensibilisateurs, la curcumine et le vert d’Indochine. Ils ont évalué la phototoxicité du traitement aux cellules HuGu.
Les résultats ont révélé que le vert d’Indochine et la curcumine réduisent significativement la viabilité des cellules HuGu à concentrations inférieures à 1000 μg / ml et 10 mM, respectivement. La cytotoxicité est plus élevée lorsque les cellules sont traitées par irradiation 2 * 30s avec un intervalle de 1 min, puis ensuite exposées au laser pendant 30s.
La thérapie photodynamique (PDT) sans colorant :
Le protocole de la « PDT sans colorant » proposé par Gérard Rey comme traitement complémentaire de la maladie parodontale, a été largement décrit dans la littérature et accepté par la communauté scientifique grâce aux résultats prouvés. Des études in vitro réalisées par G.Rey et al. ont montré une diminution significative, jusqu'à l'élimination totale de toutes les espèces bactériennes (29-31).
Caccianiga et al. (32) ont évalué l'effet bactéricide de ce protocole dans le traitement de la péri-implantite. Les résultats ont montré une diminution de la numération bactérienne de toutes les espèces bactériennes à 6 mois après le traitement jusqu'à l'élimination totale.
Une autre étude a été réalisée par le même auteur (33) pour évaluer l'effet de ce protocole sur l'élimination de tous les dépôts bactériens sur la racine ou la surface implantaire au moyen d'instruments mécaniques et d'un diode laser combiné à l’utilisation du peroxyde d’hydrogène. Les résultats montrent également une diminution importante de la quantité de bactéries pour chaque espèce jusqu'à 10-6.
Le protocole de la « PDT sans colorant », repose sur trois éléments essentiels, comme la PDT classique, qui sont :
- Un laser qui pénétre profondément dans les tissus : Ce qui explique le choix des lasers diodes et Nd-YAG avec des longueurs d’ondes se trouvant dans la zone de l’infra-rouge proche du spectre électromagnétique de la lumière. Lorsque le rayonnement laser interagit avec le tissu, quatre types d’interactions ont lieu en même temps : la transmission, la réfection, la dispersion et l’absorption (fig 4).
La distribution de l’énergie laser dans les tissus est entièrement fonction de l’absorption et de la diffusion. L’absorption détermine la profondeur de pénétration de l’énergie dans les tissus. Selon la loi de Beer-Lambert, plus le coefficient d’absorption est important, moins le rayonnement pénétre dans les tissus cibles, et plus le coefficient d’absorption est bas, plus la pénétration est importante (fig. 5).
Sachant que la plupart des tissus mous contient beaucoup d’eau, et que les longueurs d’onde se trouvant dans l’intervalle de la fenêtre optique (entre 600 et 1200nm) présentent une très faible absorption pour ce chromophore (fig. 6), il résulte une grande pénétration à l’intérieur des tissus pour ces longueurs d’onde (zone rouge et proche infra-rouge) (fig. 7).
Fig. 4 : Interaction Laser-Tissu
Fig. 5 : La loi de Beer-Lambert
Fig. 6 – Coefficient d’absorption de l’eau pour certaines longueurs d’onde
Fig. 7 Pénétration à l’intérieur des tissus selon la longueur d’onde
- Le peroxyde d’hydrogène (H2O2) avec une concentration de 3% ou Eau oxygénée est un composé chimique possédant une action antiseptique et désinfectante pour une utilisation locale.
Il peut se décomposer dans une réaction de dismutation en eau et dioxygène dans des proportions dépendantes de la température, de la concentration, de la présence d’impuretés et de stabilisants. Cependant, cette réaction de dismutation et de décomposition est lente en solution aqueuse puisque l’eau oxygénée dite « stabilisée » contient des agents permettant de complexer ou d’absorber les impuretés en solution.
C.Ferreira et Al. (34) ont mené une étude expérimentale pour évaluer l'ionisation du peroxyde d’hydrogène dans différentes solutions aqueuses et ont calculé l'énergie nécessaire pour avoir l’ionisation du peroxyde d'hydrogène.
Les résultats ont montré que l'énergie minimale requise pour décomposer le peroxyde d'hydrogène est d'environ 10,58 ± 0,04 eV, ce qui correspond à une énergie photonique très importante. Cette ionisation ne peut être possible qu'avec l'utilisation d'un Laser ultraviolet d'une longueur d'onde d'environ 120 nm. Par conséquent, les lasers de la zone infra-rouge, possédant des énergies photoniques ne dépassant pas les 1,26 eV, ne peuvent jamais dissocier le peroxyde d'hydrogène.
- Le troisième facteur est la présence du sang : le sang est un liquide qui formé par 55% de plasma et 45% de cellules, à savoir :
- Les globules blancs responsables de la réponse immunitaire,
- Les plaquettes responsables de la coagulation et l’hémostase,
- Les globules rouges (érythrocytes ou hématies) qui sont responsables essentiellement du transport d’oxygène aux différents organes.
Les hématies sont riches en hémoglobines qui sont des protéines fixant le fer qui est une catalase (fig. 8) qui permet la dismutation du peroxyde d’hydrogène (eau oxygénée) en eau et dioxygène.
En effet, La liaison oxygène-oxygène du peroxyde d'hydrogène est coupée par l'atome de fer, en créant une molécule d'eau et une liaison fer-oxygène très oxydante. Celle-ci peut oxyder une nouvelle molécule de peroxyde d'hydrogène, donnant du dioxygène. La réaction enzymatique en jeu est l'une des plus rapides connues.
Fig. 8 : Catalase du sang
Selon le protocole proposé par Gérard Rey, la première réaction est entre le H2O2 et le sang. En effet, lorsque le peroxyde d'hydrogène entre en contact avec le sang, il se décompose rapidement selon cette équation : [30]
H2O2 + Fe(III)-E H2O + O=Fe(IV)-E; H2O2 + O=Fe(IV)-E H2O + O2 + Fe(III)-E
En conséquence, les enzymes contenues dans le sang à l'intérieur de la poche parodontale catalysent ou décomposent le peroxyde d'hydrogène en H2O et O2 ; cette dernière molécule est ensuite présente en grande quantité à l'intérieur de la poche sous forme de molécule diatomique. Par la suite, le mécanisme possible qui peut se produire pour obtenir un effet bactéricide maximum, est l'excitation de cet oxygène fondamental en oxygène singulet.
L'oxygène singulet peut être formé par cinq voies possibles : réaction chimique, réaction thermique, décomposition de l'ozone, décharge électrique ou excitation directe de l'oxygène moléculaire.
Au début des années 1970, un travail de Khan et Kash (35), rapportait de nombreux états singulets d'oxygène (fig. 9). L'oxygène sous forme gazeux et liquide, a une série de bandes d'absorption soit dans la zone ultraviolet (382 et 478 nm), soit la zone visible (580 634 762 770 nm) ou la zone infrarouge (865, 1070, 1270). Les transitions optiques dans une molécule d'oxygène dans ces régions sont interdites par les règles de sélection quantique-mécanique pour la parité et le spin, cependant, l'excitation directe peut être possible dans des conditions spécifiques.
Fig. 9 : Différents états singulet de l’oxygène
N.G Basov (36), lauréat du prix Nobel, a été l'un des premiers à comprendre le potentiel des applications biologiques des lasers et a réalisé des études pour évaluer les mécanismes d'action sélective des rayonnements à faible intensité sur le sang.
Ces études ont conduit à la découverte d’un nouveau photo-accepteur qui est l’oxygène moléculaire dissous dans la phase aqueuse d'un système biologique. Ce résultat s'est révélé assez inattendu.
L'état singulet de l’oxygène 1Σ + g se désintègre rapidement (~ 10-6 s) dans les solutions en raison des collisions avec les molécules des solvants et de la présence de la population du niveau singulet 1Δg, de sorte que l'activité chimique de l'état 1Σ + g n'a pas le temps de se révéler.
Par conséquent, nous pouvons supposer que les effets biologiques observés lors de la photo-excitation de l'O2 sont causés par l'état excité 1Δg ou simplement par l'oxygène singulet. [33]
Singh et al. (37) ont rapporté que l'irradiation de l'eau avec des lasers de 990 nm et 1064 nm montre une transition vibratoire de l'eau et à la formation de l’oxygène singulet.
Zakharov et al. (38) ont découvert que la phase aqueuse des biosystèmes joue un rôle important dans le transfert d'énergie de l'oxygène singulet aux cellules. Cette hypothèse a été confirmée par l'analyse des changements de l'indice de réfraction dans une solution transparente d'éthanol-eau-peroxyde d'hydrogène irradiée par un laser He-Ne. Le type d'effet observé dans ces expériences a indiqué la genèse d’oxygène singulet par la lumière.
Zakharov et al. (39), dans une autre étude, ont rapporté que l'excitation directe des cellules tumorales a un effet inhibiteur direct sur la croissance tumorale, et les meilleurs résultats sont obtenus lorsque la quantité d'oxygène augmente au sein de l’expérimentation.
Neuman et al. (40) ont remarqué un endommagement phtotonique « photodamage » dans toute la région proche infrarouge (790–1064 nm) en surveillant les taux de rotation des cellules soumises au laser. Les dommages à l'illumination ont été réduits aux niveaux de base dans des conditions anaérobies, impliquant l'oxygène dans la voie du « photodommage ». Ils ont suggéré que la source du « photodamage », selon ces données, est la production d'oxygène à l'état excité (singulet) par irradiation laser.
Bregnhøj et al. (41) ont démontré dans une étude in-vitro, utilisant des lasers de 765nm pour irradier des cellules, que l'O2 singulet (1∆g) peut être produit avec des rendements appréciables et détectables optiquement en excitant la transition O2 fondamental à 765 nm dans des solvants liquides.
Ils ont démontré également que l'O2 singulet (1∆g) ainsi obtenu, peut être utilisé comme agent cytotoxique. La quantité d'O2 singulet (1∆g) produite par cette approche directe est comparable à celle produite lors de l'excitation d'un photosensibilisateur dans le cas d’une aPDT classique, en évitant les complications associées à l'utilisation d'un photosensibilisateur.
Krasnovsky (42) a mis en évidence ce mode de génération directe d'oxygène singulet dans le cadre d'une étude de photo-oxydation d'une sonde spécifique d'oxygène singulet.
Cette excitation directe de l'oxygène moléculaire est appelée « LIGHT OXYGEN EFFECT » (LOE) ou effet de l’oxygène irradié par la lumière. Le « LIGHT OXYGEN EFFECT » représente des dommages, à faibles doses, des cellules par photo-génération d'oxygène singulet à partir Du dioxygène (O2) présent dans les cellules conformément à la réaction :
3O2 + hν 1O2.
La longueur d'onde du laser utilisé dans le (LOE) doit avoir l'énergie d'excitation minimale (94,2 kj / mol) pour créer l'état singulet de l'oxygène (à partir de 1270 nm et moins).
Conclusion :
Le mécanisme biochimique de la thérapie photodynamique sans colorant proposée par Gérard Rey, semble impliquer la « LIGHT OXYGEN EFFECT » (LOE), dans laquelle le laser est capable d'exciter directement l'O2 tissulaire dans des conditions sélectionnées, et le H2O2 appliqué, améliore la production d'O2 via sa décomposition par contact avec les catalases de l’hémoglobine du sang.
Comparé à la thérapie photodynamique classique, ce protocole semble sûr et l'utilisation des paramètres contrôlés de bas niveau d’énergie, évite les augmentations thermiques défavorables et ainsi les dommages aux tissus environnants
Références :
- Loesche, W. J. The Role of Spirochetes in Periodontal Disease. Adv Dent Res. 1988,(2), 275–283. https://doi.org/10.1177/08959374880020021201.
- Socransky, S. S.; Haffajee, A. D.; Cugini, M. A.; Smith, C.; Kent, R. L. Microbial Complexes in Subgingival Plaque. J Clin Periodontol 1998, 25 (2), 134–144. https://doi.org/10.1111/j.1600-051X.1998.tb02419.x.
- Jithendra, K.; Bansali, A.; Ramachandra, S. Failures in Periodontal Therapy. Bangladesh J Med Sci 1970, 9 (4), 193–198. https://doi.org/10.3329/bjms.v9i4.6680.
- Kepic, T. J.; O’Leary, T. J.; Kafrawy, A. H. Total Calculus Removal: An Attainable Objective? Journal of Periodontology 1990, 61 (1), 16–20. https://doi.org/10.1902/jop.1990.61.1.16.
- Magnusson, I.; Lindhe, J.; Yoneyama, T.; Liljenberg, B. Recolonization of a Subgingival Microbiota Following Scaling in Deep Pockets. J Clin Periodontol 1984, 11 (3), 193–207. https://doi.org/10.1111/j.1600-051X.1984.tb01323.x.
- Rhemrev, G. E.; Timmerman, M. F.; Veldkamp, I.; Van Winkelhoff, A. J.; Van der Velden, U. Immediate Effect of Instrumentation on the Subgingival Microflora in Deep Inflamed Pockets under Strict Plaque Control. J Clin Periodontol 2006, 33 (1), 42–48. https://doi.org/10.1111/j.1600-051X.2005.00871.x.
- Schenk, G.; Flemmig, T. F.; Lob, S.; Ruckdeschel, G.; Hickel, R. Lack of Antimicrobial Effect on Periodontopathic Bacteria by Ultrasonic and Sonic Scalers in Vitro. Journal of Clinical Periodontology 2000, 27 (2), 116–119. https://doi.org/10.1034/j.1600-051x.2000.027002116.x.
- Bollen, C. M. L.; Quirynen, M. Microbiological Response to Mechanical Treatment in Combination With Adjunctive Therapy. A Review of the Literature. Journal of Periodontology 1996, 67 (11), 1143–1158. https://doi.org/10.1902/jop.1996.67.11.1143.
- Cobb, C. M. Lasers in Periodontics: A Review of the Literature. Journal of Periodontology 2006, 77 (4), 545–564. https://doi.org/10.1902/jop.2006.050417.
- Romanos, G. Current Concepts in the Use of Lasers in Periodontal and Implant Dentistry. J Indian Soc Periodontol 2015, 19 (5), 490. https://doi.org/10.4103/0972-124X.153471.
- Moritz, A.; Schoop, U.; Goharkhay, K.; Schauer, P.; Doertbudak ,O.; Wernisch, J. et al. Treatment of periodontal pockets with a diode laser. Lasers in Surgery and Medicine. 1998, 22(5), 302-311 doi:10.1002/1096-9101(1998)22:5<302:aid-lsm7>3.0.co;2-t
- Kamma, J. J.; Vasdekis, V. G. S.; Romanos, G. E. The Effect of Diode Laser (980 Nm) Treatment on Aggressive Periodontitis: Evaluation of Microbial and Clinical Parameters. Photomedicine and Laser Surgery 2009, 27 (1), 11–19. https://doi.org/10.1089/pho.2007.2233.
- Dukić, W.; Bago, I.; Aurer, A.; Roguljić, M. Clinical Effectiveness of Diode Laser Therapy as an Adjunct to Non-Surgical Periodontal Treatment: A Randomized Clinical Study. Journal of Periodontology 2013, 84 (8), 1111–1117. https://doi.org/10.1902/jop.2012.110708.
- Gokhale, S. R.; Padhye, A. M.; Byakod, G.; Jain, S. A.; Padbidri, V.; Shivaswamy, S. A Comparative Evaluation of the Efficacy of Diode Laser as an Adjunct to Mechanical Debridement Versus Conventional Mechanical Debridement in Periodontal Flap Surgery: A Clinical and Microbiological Study. Photomedicine and Laser Surgery 2012, 30 (10), 598–603. https://doi.org/10.1089/pho.2012.3252.
- Caruso, U.; Nastri, L.; Piccolomini, R.; d’Ercole, S.; Mazza, C.; Guida, L. Use of Diode Laser 980 Nm as Adjunctive Therapy in the Treatment of Chronic Periodontitis. A Randomized Controlled Clinical Trial. New Microbiol. 2008, 31 (4), 513–518.
- Borrajo, J. L. L.; Varela, L. G.; Castro, G. L.; Rodríguez-Nuñez, I.; Torreira, M. G. Diode Laser (980 Nm) as Adjunct to Scaling and Root Planing. Photomedicine and Laser Surgery 2004, 22 (6), 509–512. https://doi.org/10.1089/pho.2004.22.509.
- Russell, A. D. Lethal Effects of Heat on Bacterial Physiology and Structure. Science Progress 2003, 86 (1–2), 115–137. https://doi.org/10.3184/003685003783238699.
- Kreisler, M.; Al Haj, H.; Daubländer, M.; Götz, H.; Duschner, H.; Willershausen, B.; d’Hoedt, B. Effect of Diode Laser Irradiation on Root Surfaces in Vitro. Journal of Clinical Laser Medicine & Surgery 2002, 20 (2), 63–69. https://doi.org/10.1089/104454702753768034.
- Prates, R. A.; Yamada, A. M.; Suzuki, L. C.; França, C. M.; Cai, S.; Mayer, M. P. A.; Ribeiro, A. C.; Ribeiro, M. S. Histomorphometric and Microbiological Assessment of Photodynamic Therapy as an Adjuvant Treatment for Periodontitis: A Short-Term Evaluation of Inflammatory Periodontal Conditions and Bacterial Reduction in a Rat Model. Photomedicine and Laser Surgery 2011, 29 (12), 835–844. https://doi.org/10.1089/pho.2010.2984.
- Segarra-Vidal, M.; Guerra-Ojeda, S.; Vallés, L. S.; López-Roldán, A.; Mauricio, M. D.; Aldasoro, M.; Alpiste-Illueca, F.; Vila, J. M. Effects of Photodynamic Therapy in Periodontal Treatment: A Randomized, Controlled Clinical Trial. J Clin Periodontol 2017, 44 (9), 915–925. https://doi.org/10.1111/jcpe.12768.
- Berakdar, M.; Callaway, A.; Fakhr Eddin, M.; Roß, A.; Willershausen, B. Comparison between Scaling-Root-Planing (SRP) and SRP/Photodynamic Therapy: Six-Month Study. Head Face Med 2012, 8 (1), 12. https://doi.org/10.1186/1746-160X-8-12.
- Ge, L.; Shu, R.; Li, Y.; Li, C.; Luo, L.; Song, Z.; Xie, Y.; Liu, D. Adjunctive Effect of Photodynamic Therapy to Scaling and Root Planing in the Treatment of Chronic Periodontitis. Photomedicine and Laser Surgery 2011, 29 (1), 33–37. https://doi.org/10.1089/pho.2009.2727.
- Betsy, J.; Prasanth, C. S.; Baiju, K. V.; Prasanthila, J.; Subhash, N. Efficacy of Antimicrobial Photodynamic Therapy in the Management of Chronic Periodontitis: A Randomized Controlled Clinical Trial. J Clin Periodontol 2014, 41 (6), 573–581. https://doi.org/10.1111/jcpe.12249.
- Coluzzi, DJ.; Parker, SPA. Textbooks in Contemporary Dentistry Lasers in Dentistry – Current Concepts Springer 2017. p.1130
- Rey, G. ; Missika. P. Traitements parodontaux et lasers en omnipratique dentaire. Elsevier Masson 2010, p 18-19 ISBN : 978-2294708572
- Marta Segarra-Vidal, Sol Guerra-Ojeda, Lilian Soraya Vallés, Andrés López-Roldán,María Dolores Mauricio, Martín Aldasoro Et Al. Effects of photodynamic therapy in periodontal treatment: A randomized, controlled clinical trial. J Clin Periodontol.2017;44:915–925.
- Mohammad Berakdar, Angelika Callaway, Mohammad Fakhr Eddin, Armin Roß and Brita Willershausen. Comparison between scaling-root-planing (SRP) and SRP/photodynamic therapy: six-month study. Berakdar et al. Head & Face Medicine 2012, 8:12
- Pourhajibagher M, Chiniforush N, Parker S, Shahabi S, Ghorbanzadeh R, Kharazifard and Al. Evaluation of antimicrobial photodynamic therapy with indocyanine green and curcumin on human gingival fibroblast cells: An in vitro photocytotoxicity investigation. Photodiagnosis and Photodynamic Therapy ; 2016
- Rey, G. ; Missika. P. Traitements parodontaux et lasers en omnipratique dentaire. Elsevier Masson 2010, p 18-19 ISBN : 978-2294708572
- Rey, G. ; Missika, P. Traitements parodontaux et lasers en omnipratique dentaire. Elsevier Masson 2010, p 47-55. ISBN : 978-2294708572
- Rey, G. L’efficacité vérifiée des traitements parodontaux assistés aux lasers diodes. Lettres de Stomatologie 2016, 72(11), 9-28
- Caccianiga, G.; Rey, G.; Baldoni, M.; Paiusco, A. Clinical, Radiographic and Microbiological Evaluation of High Level Laser Therapy, a New Photodynamic Therapy Protocol, in Peri-Implantitis Treatment; a Pilot Experience. BioMed Research International 2016, 2016, 1–8. https://doi.org/10.1155/2016/6321906.
- Caccianiga, G.; Rey, G.; Fumagalli, T.; Cambini, A.; Denotti, G.; Giacomello, M. S. Photodynamic Therapy (Association Diode Laser/Hydrogen Peroxide): Evaluation of Bactericidal Effects on Periodontopathy Bacteria: An in Vitro Study. Eur J Inflamm 2012, 10 (2_suppl), 101–106. https://doi.org/10.1177/1721727X120100S220.
- C. Ferreira, Hugo F. M. C. Martiniano, Benedito J. Costa Cabral, V. Aquilanti. Electronic Excitation and Ionization of Hydrogen Peroxide–Water Clusters:Comparison With Water Clusters. International Journal of Quantum Chemistry, Vol 111, 1824–1835 (2011).
- Khan, A. U.; Kasha, Michael. Chemiluminescence Arising from Simultaneous Transitions in Pairs of Singlet Oxygen Molecules. J. Am. Chem. Soc. 1970, 92 (11), 3293–3300. https://doi.org/10.1021/ja00714a010.
- Basov, О. kvantovoi elektronike (On Quantum Electronics) 144. (Moscow: Nauka, 1987) p. 72
- Singh, A.; Koroll, G. W.; Antonsen, S. A. Possible Formation of Singlet Oxygen from Vibrationally Excited Water. Journal of Photochemistry 1984, 25 (2–4), 99–104. https://doi.org/10.1016/0047-2670(84)87013-6.
- Zakharov, S. D.; Ivanov, A. V.; Wolf, E. B.; Danilov, V. P.; Murina, T. M.; Nguen, K. T.; Novikov, E. G.; Panasenko, N. A.; Perov, S. N.; Skopinov, S. A.; Timofeev, Y. P. Structural Rearrangements in the Aqueous Phase of Cell Suspensions and Protein Solutions Induced by a Light-Oxygen Effect. Quantum Electron. 2003, 33 (2), 149–162. https://doi.org/10.1070/QE2003v033n02ABEH002376.
- Zakharov, S. D.; Ivanov, A. V. Light-Oxygen Effect in Cells and Its Potential Applications in Tumour Therapy (Review). Quantum Electron. 1999, 29 (12), 1031–1053. https://doi.org/10.1070/QE1999v029n12ABEH001629.
- Neuman, K. C.; Chadd, E. H.; Liou, G. F.; Bergman, K.; Block, S. M. Characterization of Photodamage to Escherichia Coli in Optical Traps. Biophysical Journal 1999, 77 (5), 2856–2863. https://doi.org/10.1016/S0006-3495(99)77117-1.
- Bregnhøj, M., Blázquez-Castro, A., Westberg, M., Breitenbach, T., & Ogilby, P. R. (2015). Direct 765 nm Optical Excitation of Molecular Oxygen in Solution and in Single Mammalian Cells. The Journal of Physical Chemistry B, 119(17), 5422–5429. doi:10.1021/acs.jpcb.5b01727
- Krasnovsky, A. A.; Kozlov, A. S.; Roumbal, Ya. V. Photochemical Investigation of the IR Absorption Bands of Molecular Oxygen in Organic and Aqueous Environment. Photochem. Photobiol. Sci. 2012, 11 (6), 988. https://doi.org/10.1039/c2pp05350k.