Evaluation du traitement laser- er:yag + ozone dans la gestion des ostéonécroses M.R.O.N.J.
 Objectifs: Evaluation de l'efficacité de l'association du gel d'ozone et du laser Er: YAG dans le traitement de l'ostéonécrose médicamenteuse des mâchoires (MRONJ).
Objectifs: Evaluation de l'efficacité de l'association du gel d'ozone et du laser Er: YAG dans le traitement de l'ostéonécrose médicamenteuse des mâchoires (MRONJ).
Auteur : Dr Porcaro Gianluca, Ornaghi Marco, Dr Bonacina Cristiano, Dr Gianluigi Caccianiga, Maddalone Marcello.
Université de Milano-Bicocca, Monza, Italie. Directeur : Prof. Marco Baldoni.
Matériel et méthodes : 7 patients atteints de MRONJ ont été traités avec un protocole qui fournit une thérapie médicale à domicile et à l'hôpital (Tm) + une thérapie à l'ozone + un traitement chirurgicale avec le laser Er: YAG.
Résultats: Le protocole décrit, ainsi appliqué, a conduit à la rémission complète de l'estéonécrose (lésions) chez tous les sujets (cicatrisation à 100%).
Conclusions: Le traitement combiné proposé permet d'obtenir d'excellents résultats dans la résolution de MRONJ.
MOTS CLÉS:
MRONJ; bisphosphonates; Chirurgie buccale; ozone; Er: YAG Laser.
INTRODUCTION
MRONJ représente une condition pathologique, affectant les os maxillaires, invalidante et fortement dégénérative ; les trois éléments qui permettent le diagnostic de cette condition (1) sont :
1. Traitement anti-angiogénétique ou anti-résorption en cours ou avant
2. Os exposé ou os sondable par une ou plusieurs fistules intra ou extra-orales dans la région maxillo-faciale pendant plus de 8 semaines
3. Pas de radiothérapie du district tête-cou dans l'anamnèse.(1)
OBJECTIFS THÉRAPEUTIQUES
Conformément à la prise de position de l'AAOMS1 2014, les principaux objectifs du traitement chez les patients à risque ou avec MRONJ sont les suivants:
1) Priorité de la thérapie anticancéreuse avec des médicaments anti-résorption / anti-angiogéniques par rapport à la résolution de MRONJ.
2) Préservation de la qualité de vie par:
- Éducation et réconfort du patient, formé à une hygiène bucco-dentaire dédiée et invité à des visites de suivi fréquentes pour éviter les récidives
- Contrôle de la douleur grâce à la pharmacothérapie
- Prévention de l'extension des lésions et développement de nouvelles lésions ostéonécrotiques (1)
CHOIX THÉRAPEUTIQUE
À ce moment, des thérapies médicales ou chirurgicales sont suivies.
Thérapie conservatrice ou médicale : consiste à éliminer les foyers infectieux par l'hygiène professionnelle et domestique, la résolution des foyers pathogènes oraux, l'administration d'antibiotiques locaux ou systémiques.
En outre, des thérapies conservatrices d'utilisation clinique récente sont indiquées, telles que:
- Thérapie à l'ozone : (augmente la concentration des érythrocytes et le taux d'hémoglobine, la stimulation de la diapédèse, la phagocytose et a des effets germicides et analgésiques. La thérapie à l'ozone peut être associée à la chirurgie pré et peropératoire.2)
- Thérapie laser de bas niveau (LLLT): (avec une action biostimulante, qui favoriserait le processus de cicatrisation au niveau des tissus péri-lésionnels, et une action antibactérienne.(3). La LLLT peut être associée à la chirurgie pré et peropératoire. (4)
La thérapie chirurgicale consiste à retirer la partie osseuse nécrotique, qui présente fréquemment des surinfections.
Selon le caractère invasif, il est possible de distinguer
- Chirurgie par approche conservatrice (Débridement chirurgical avec coupe osseuse, Chirurgie piézoélectrique, Chirurgie assistée par laser)
- Chirurgie résective et reconstructive (permet une résection osseuse large avec des marges saines avec rééducation par lambeaux avec vascularisation propre).
OBJET:
Le but de la recherche est d'évaluer l'efficacité du protocole proposé pour le traitement de l'ostéonécrose liée aux médicaments.
MATÉRIAUX ET MÉTHODES:
Sept lésions maxillaires ostéonécrotiques liées au médicament (MRONJ) (stade 44-85 ans, moyenne 69 ans) de stade I, II et III ont été sélectionnées. Les patients inclus dans l'étude ont été traités de janvier 2011 à juillet 2015. Des antécédents médicaux et dentaires proches et éloignés ont été collectés pour chaque patient. Chaque lésion a été mise en scène par une investigation clinique et radiographique conformément à la classification de Ruggiero de 20066 et AAOMS de 2009, 20141; (7)
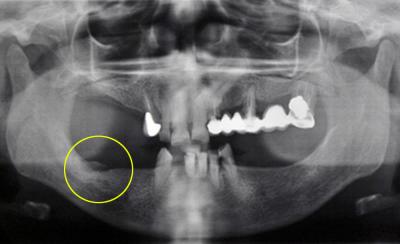
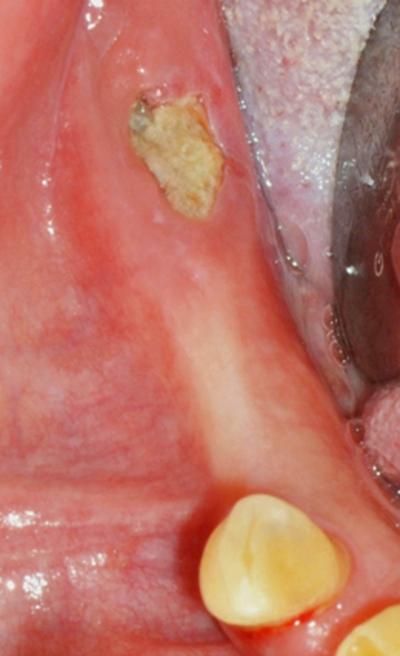
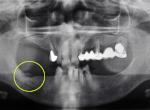
Fig. 1 et 2 : Exemple d’un cas clinique : radiographie et état initial
Critères d'inclusion
- Présence totale d'ostéonécrose des mâchoires due aux médicaments (MRONJ)
Critères d'exclusion
- Ostéonécrose des mâchoires non exclusivement liée aux médicaments (radiothérapie de la région ORN tête-cou)
- Pathologies systémiques non compensées
- Pathologie cancéreuse contre-indiquant l'intervention
- Absence de conformité
Le protocole prévoit un organigramme spécifique :
1. Initialement, une thérapie médicale (TM) est effectuée,
2. 8 applications de gel ozone 1 fois par semaine,
3. Séance de chirurgie au laser Er:YAG,
4. Surveillance de la guérison pendant au moins 12 mois.
La thérapie médicale (TM) comprend:
- Pansements hospitaliers
Pansements de lésions ostéonécrotiques tous les 7 jours: irrigation avec solution physiologique et application du gel de peroxyde d'hydrogène à 0,8% (H2O2) pendant 15 minutes.
- Pansements maison
À la maison, chaque patient a également irrigué la plaie avec une solution saline toutes les 12 heures à la fin de chaque repas.
Les patients ou les membres de la famille ont ensuite été invités à panser la plaie. Un gel de peroxyde d'hydrogène à 0,8% a été appliqué pendant 15 minutes 1 fois par jour après le nettoyage de l'exposition osseuse avec la solution physiologique.
- antibiotiques administrés par intermittence ou en continu, en cas de surinfection péri-lésionnelle des tissus mous avec suppuration et symptômes douloureux (stade MRONJ II, III).
Un traitement pharmacologique périopératoire adéquat et prolongé a été d'une importance fondamentale afin de minimiser les risques de surinfection. L'antibiothérapie conseillée est : clavulanate d'amoxicilline en comprimés de 1 gr toutes les 12 heures + métronidazole en comprimés de 250 mg toutes les 8 heures afin d'acquérir une couverture antibiotique complète également contre les bactéries anaérobies, la durée d'administration était de 7 jours en cas de traitement médical exclusif et 14 jours en cas d’intervention chirurgicale programmée le septième jour, pour un traitement combiné.
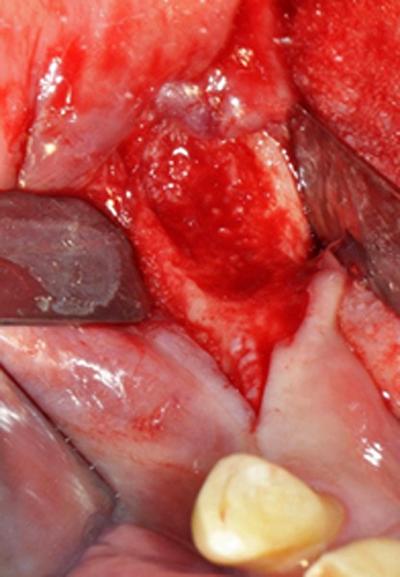
Fig.3 – Retrait du séquestre et chirurgie ablative
Thérapie à l'ozone : après le pansement, un gel d'ozone a été appliqué à la clinique tous les 7 jours. En même temps que le premier traitement, une empreinte a été prise pour chaque patient et pour créer un support pour les applications ultérieures de gel ozoné. Tous les patients n'ont pas consenti à la réalisation du support, donc une gaze stérile recouvrant le gel a été utilisée pour ceux-ci afin d'éviter l'évaporation. Chaque séance a duré 8 à 10 minutes sous aspiration continue pour éviter l'inhalation de gaz.
La chirurgie au laser Er:YAG a fourni le même protocole de préparation médicale, mais le débridement a été traité dans ce cas avec un laser Er:YAG reglé avec une énergie de 400 mJ - fréquence 13 Hz - Mode VSP - fluence de 50 J / cm2 au-dessus de 300 mJ - irrigation avec de l'eau distillée.
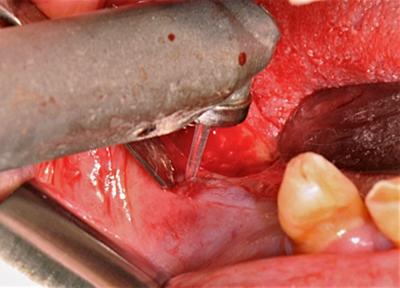
Fig.4 – Apport du laser Er :YAG
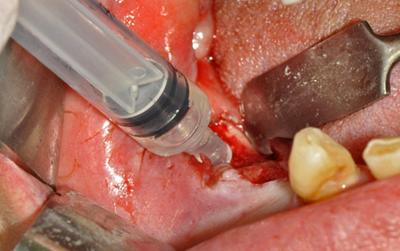
Fig.5 - Application d’un gel d’ozone
RÉSULTATS
Tous les patients ont été réévalués chaque semaine le premier mois, tous les mois au semestre suivant, puis tous les 3 mois pendant un an. Par la suite, des bilans semestriels sont mis en place pour la maintenance de l'hygiène buccale. Le contrôle radiographique a été effectué à 6 et 12 mois après le dernier traitement.
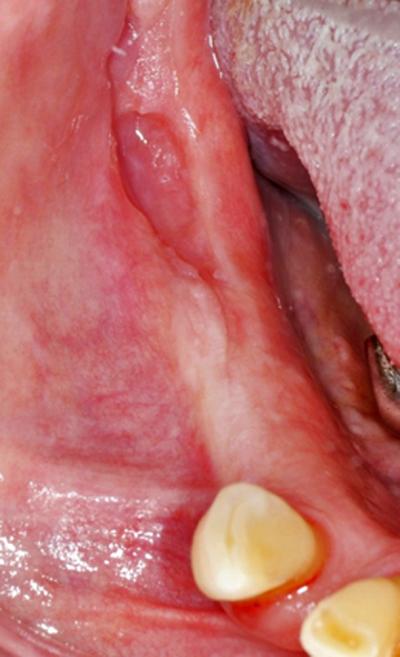
Fig.6 – Résultat
La guérison était divisée en:
- Guérison complète (si maintenue pendant au moins 12 mois) 1
- Cicatrisation incomplète avec ou sans réduction de stade
EXEMPLE D'ANALYSE
TM + Thérapie à l'ozone + Chirurgie au laser Er:YAG: tous les patients traités ont obtenu une guérison clinique et radiographique complète (100%).
DISCUSSION
Plusieurs protocoles ont été proposés dans la littérature car à ce jour il n'y a pas de consensus commun (8). Selon les prises de position de l'AAOMS 2009 et 20141, le traitement médical est considéré comme le premier choix pour les stades I et II; la thérapie chirurgicale, en revanche, est réservée aux patients de stade III ou aux patients chez qui la thérapie médicale n'a pas conduit à une amélioration efficace des symptômes (stade II) (1,7,9).
Malgré cela, des protocoles chirurgicaux ont également été envisagés dans la littérature pour les lésions ostéonécrotiques de stade I et II avec d'excellents résultats et des pourcentages plus élevés de guérisons partielles et completes (10).
L'approche chirurgicale permet en effet l'ablation des tissus nécrotiques qui, n'ayant pas de capacité régénérative et réparatrice, interfèrent avec la cicatrisation des plaies (11). Une récente revue systématique de la littérature par Fliefel et al. (12) montre que l'utilisation de protocoles chirurgicaux superficiels, tels que le débridement, est le choix thérapeutique le plus appliqué. La recherche d'une approche chirurgicale mini-invasive permet une meilleure préservation du tissu osseux sain, en évitant un affaiblissement excessif des os maxillaires et permettant une rééducation prothétique mobile ultérieure.
Parmi les protocoles chirurgicaux mini-invasifs, l'utilisation de la chirurgie au laser permet d'obtenir des résultats intéressants. Comme il est montré dans cette étude, les patients traités par chirurgie au laser avaient un taux de guérison complet de 100% ; ces données confirment ce qui est rapporté dans la littérature internationale (13, 14).
Ce succès s'explique par une série de caractéristiques propres à la technologie laser. En effet, grâce aux propriétés photoacoustiques, photochimiques, photothermiques et photomécaniques, le laser permet de réduire la charge bactérienne au niveau du site d'intervention.
De plus, avec la chirurgie au laser, une couche de “smear layer” n'est pas produite sur la surface osseuse, situation typique avec des instruments rotatifs: la vaporisation de l'eau favorise un effet de nettoyage sur le site chirurgical qui permet l'élimination rapide du tissu traité.
Le résultat est un champ de fonctionnement extrêmement propre. Une autre caractéristique importante est la propriété biostimulatrice du laser, au niveau osseux, elle favorise le processus de guérison dans la période post-chirurgicale (15). Une thérapie à l'ozone a également été réalisée dans cette étude.
Les données de la littérature suggèrent une excellente efficacité de l'application du gel ozoné à la fois lorsqu'elle est effectuée individuellement et en association avec une thérapie chirurgicale. Les diverses propriétés de l'ozone comprennent: un effet antimicrobien contre les bactéries, champignons et virus anaérobies et aérobies (16); stimulation de la production d'hémoglobline et de globules rouges avec augmentation relative de l'oxygénation du sang; régulation des cytokines impliquées dans la réponse immunitaire ; augmentation de la phagocytose et de la diapédèse, stimulation de l'angiogenèse et des fibroblastes.
Cliniquement, l'ozone induit la formation d'une saisie osseuse, stimule la vascularisation de l'os sous-jacent et stimule la formation de tissu de granulation.
Par conséquent, l'élimination de ces lésions expose le tissu osseux sous-jacent dans la phase de régénération à l'environnement buccal, ce qui n'est pas nécessaire pour traiter chirurgicalement (17 ). Agrillo et al.(18) ont utilisé une thérapie topique à l'ozone dans le traitement de MRONJ en obtenant une rémission des symptômes dans 90% des cas , et Ripamonti et al.(19), également,
ils ont appliqué cette méthode associée à la thérapie médicale pour le seul traitement conservateur des lésions ostéonécrotiques de moins de 2,5 cm, en obtenant une résolution avec guérison complète de toutes les lésions analysées .
Les résultats obtenus dans cette étude confirment que, s'ils sont associés à la chirurgie au laser, des guérisons complètes à 100% peuvent être obtenues.
Par conséquence, la thérapie à l'ozone peut être combinée avec une thérapie médicale dans la prise en charge initiale de MRONJ et peut être utilisée dans la préparation d'un traitement chirurgical, dans la phase peropératoire, après avoir effectué l'ablation complète de la lésion et dans la phase de guérison post-chirurgicale.
Grâce aux propriétés énumérées précédemment, l'ozonothérapie peut également être utilisée chez les patients de stade II et III, où, en raison de problèmes oncologiques, une approche chirurgicale n'est pas autorisée.
CONCLUSIONS
En considerant ce qui a été mis en évidence par cette étude, on peut dire que le traitement chirurgical conservateur est également un choix valable dans les lésions de stade I et II et que la chirurgie au laser associée au gel ozoné s'avère extrêmement efficace dans le traitement de MRONJ.
Ces déclarations sont conformes à la littérature internationale (20, 21,22; 23, 24, 25, 26, 27) où de nombreux articles affirment le succès d'une approche chirurgicale-conservatrice associé à une thérapie de soutien (thérapie au laser ou à l'ozone) peut être utilisé pour améliorer la prise en charge chirurgicale (8)
CONFLITS D'INTÉRÊTS
Dans l'article présenté, il n'y a pas de conflits d'intérêts économiques ou autres.
Bibliographie
1. Ruggiero SL, Dodson TB, Fantasia J, Goodday R, Aghaloo T, Mehrotra B, et al. American Association of Oral and Maxillofacial Surgeons Position Paper on medication-related osteonecrosis of the jaw—2014 update. J Oral Maxillofac Surg 2014;72:1938–56.
2 . Vescovi P. Osteonecrosi dei mascellari e bifosfonati. Terapia odontoiatrica e prevenzione. 9 Tecniche Nuove. 2008.
3 . Maggioni M, Attanasio T, Scarpelli F. I Laser in Odontoiatria, Piccin 2009/10.
4 . Vescovi P, Merigo E, Meleti M, Manfredi M, Fornaini C, Nammour S, et al . Conservative Surgical Management of Stage I 11 Bisphosphonate-Related Osteonecrosis of the Jaw. Int J Dent 2014.
5 . Mücke T, Haarmann S, Wolff KD, Hölzle F. Bisphosphonate related osteonecrosis of the jaws 17 treated by surgical resection and immediate osseous microvascular reconstruction. J Craniomaxillofac Surg. 2009 Jul;37(5):291-7
6 .Ruggiero S, Gralow J, Marx RE, Hoff AO, Schubert MM, Huryn JM et al. Practical guidelines for the prevention, diagnosis, and treatment of osteonecrosis of the jaw in patients with cancer. J Oncol Pract. 2006 Jan;2(1):7-14.
7 . Ruggiero SL, Dodson TB, Assael LA, Landesberg R, Marx RE, Mehrotra B, et al. American 37 Association of Oral and Maxillofacial Surgeons Position Paper on bisphosphonate-related osteonecrosis of the jaw—2009 update. Aust Endod J 2009;35:119–30.
8. Fliefel R, Tröltzsch M, Kühnisch J, Ehrenfeld M, Otto S. Treatment strategies and outcomes 35 of bisphosphonate-related osteonecrosis of the jaw (BRONJ) with characterization of patients: a systematic review. Int J Oral Maxillofac Surg. 2015 May;44(5):568-85.
9 . American Association of Oral and Maxillofacial Surgeons. Position Paper on bisphosphonate related osteonecrosis of the jaws. J Oral Maxillofac Surg 2007;65: 369–76.
10 . Holzinger D, Seemann R, Klug C, Ewers R, Millesi G, Baumann A, et al. Long-term success of surgery in bisphosphonate-related osteonecrosis of the jaws (BRONJs). Oral Oncol 2013;49:66–70.
11 . Ristow O, Otto S, Troeltzsch M, Hohlweg-Majert B, Pautke C. Treatment perspectives for 39 medication-related osteonecrosis of the jaw (MRONJ). J of Cranio-Maxillo-Facial Surgery 43 (2015) 290-293
12 . Sutent : EPAR - Product Information. http://www.ema.europa.eu/docs/it_IT/ 30 document_library/EPAR_-_Product_Information/human/000687/WC500057737.pdf Pubblicato 18/11/2009. Ultimo aggiornamento 27/07/201.
13 . Vescovi P, Merigo E, Meleti M, Manfredi M, Guidotti R, Nammour S. Bisphosphonates related osteonecrosis of the jaws: a concise review of the literature and a report of a single-centre experience with 151 patients. J Oral Pathol Med 2012;41: 214–21.
14 . Stübinger S, Dissmann JP, Pinho NC, Saldamli B, Seitz O, Sader R. A preliminary report 44 about treatment of bisphosphonate related osteonecrosis of the jaw with Er:YAG laser ablation. Lasers Surg Med 2009;41:26–30.
15 . Leucht P, Lam K, Kim JB, Mackanos MA, Simanovskii DM, Longaker MT, Contag CH, 45 Schwettman HA, Helms JA. Accelerated bone repair after plasma laser corticotomies. Ann Surg 2007;246:140 – 150.
16 . Muller P, Guggenheim B, Shmidlin P. Efficacy of gasiform ozone and photodynamic therapy 47 on a multispecies oral biofilm in vitro. Eur J Oral Sci 2007; 115: 77-80.
17 . Steinhart H, Schultz S, Mutters R. Evaluation of ozonated oxygen in an experimental animal 48 model of osteomyelitis as a further treatment option for skull-base osteomyelitis. Eur Arch Otorhinolaryngol 1999; 256: 153-157.
18 . Agrillo A, Ungari C, Filiaci F, Priore P,Iannetti G. Ozone therapy in the treatment of avascular 49
bisphosphonate-related jaw osteonecrosis. J Craniofac Surg 2007; 18: 1071-1075.
19 . Ripamonti CI et al. Efficacy and safety of medical ozone (O3) delivered in oil suspension 50 applications for the treatment of osteonecrosis of the jaw in patients with bone metastases treated with bisphosphonates: Preliminary results of a phase I–II study. Oral Oncol. 2011 Mar;47(3): 185-9.
20 . Beth-Tasdogan NH, Mayer B, Hussein H, Zolk O. Interventions for managing medication related osteonecrosis of the jaw. Cochrane Database Syst Rev. 2017 Oct 6;10:CD012432.
21 . Momesso GAC, de Souza Batista FR, de Sousa CA, de Lima VN, Polo TOB, Hassumi JS, et al. Successful Use of Lower-Level Laser Therapy in the Treatment of Medication-Related Osteonecrosis of the Jaw. J Lasers Med Sci. 2017 Fall;8(4):201-203.
22 . Aida Comas-Calonge , Rui Figueiredo , Cosme Gay-Escoda. Surgical treatment vs. conservative treatment in intravenous bisphosphonate related osteonecrosis of the jaws. Systematic review. J Clin Exp Dent. 2017 Feb 1;9(2):e302-e307.
23 . Takanori Eguchi , Ikuyo Kanai , Akihiko Basugi , Yukinaga Miyata , Minako Inoue , Yoshiki Hamada. The assessment of surgical and non-surgical treatment of stage II medication-related osteonecrosis of the jaw. Med Oral Patol Oral Cir Bucal. 2017 Nov 1;22(6):e788-e795.
24 . Sıdıka Sinem Akdeniz, E. Beyler, Y. Korkmaz, E. Yurtcu, U. Ates, K. Araz, et al. The effects of ozone application on genotoxic damage and wound healing in bisphosphonate-applied human gingival fibroblast cells. Clin Oral Investig. 2018 Mar;22(2):867-873.
25 . Blus C, Giannelli G, Szmukler-Moncler S, Orru G. Treatment of medication-related osteonecrosis of the jaws (MRONJ) with ultrasonic piezoelectric bone surgery. A case series of 20 treated sites. J Oral Maxillofac Surg. 2017 Mar;21(1):41-48.
26 . Oteri G, De Ponte FS, Runci M, Peditto M, Marcianò A, Cicciù M. Oral-Health-Related Quality of Life After Surgical Treatment of Osteonecrosis of the Jaws. J Craniofac Surg. 2018 Mar;29(2):403-408.
27 . Lopes RN, Rabelo GD, Rocha AC, Carvalho PA, Alves FA. Surgical Therapy for Bisphosphonate-Related Osteonecrosis of the Jaw: Six-Year Experience of a Single Institution. J Oral Maxillofac Surg. 2015 Jul;73(7):1288-95.
Tableaux :
Group
N° patients
Thérapie
Group 1
11
Thérapie medicale (tm)
Group 2
9
Tm + chirurgie conservatrice avec instruments rotatifs/piezo-electtrics
Group 3
14
Tm + ozonothérape
Group 4
11
Tm + traitement chirurgical Laser Er: YAG
Group 5
7
Tm + ozonothérape + traitement chirurgical + laser Er: YAG.
Tableau I : répartition en groupes du nombre total de patients
Group
N°
Guérisons incomplètes
% Guérisons incomplètes
Guérisons complètes
% Guérisons complètes
Gruppo 1
11
5
45%
0
0%
Gruppo 2
13
3
15%
5
38,5%
Gruppo 3
9
1
11%
7
78%
Gruppo 4
11
2
18%
9
82%
Gruppo 5
7
0
0%
7
100%
Tableau II : guérisons complètes et incomplètes pour chaque groupe.
Group
Wilcoxon Signed-Rank Test
Group 1
traitement significatif (≤ 0.05)
Group 2
traitement significatif (≤ 0.05)
Group 3
traitement significatif (≤ 0.05)
Group 4
traitement significatif (≤ 0.05)
Group 5
traitement significatif (≤ 0.05)
Tableau III: Résultats du test de Wilcoxon appliqué à chaque groupe individuel
Group 2
Group 3
Group 4
Group 5
Group 1
0.030613
0.00094
<0,000001
0.000123
Group 2
-
0.055086
0.019369
0.027605
Group 3
-
-
0.5657
0.8415
Group 4
-
-
-
0.8065
Group 5
-
-
-
-
Tableau IV. Comparaison entre les groupes avec le test du chi carré. Les valeurs pour lesquelles il n'y a pas de différence statistiquement significative sont surlignées en rouge.