Existe-t-il une prédisposition entre maladies parodontales et détresse respiratoire liée au covid-19?
Mécanisme inflammatoire de la Covid-19 : l’orage cytokinique, l’effet « auto-immun.
Auteurs : Pierre MONATTE
INTRODUCTION
La Covid-19 désigne la maladie provoquée par le nouveau coronavirus, le SARS-CoV-2.
L’émergence du SARS-Cov-2 constitue la troisième apparition d’un coronavirus hautement pathogène et hautement contagieux dans l’espèce humaine au XXIème siècle depuis le coronavirus responsable d’un syndrome respiratoire aigu sévère en 2002 (SARS-Cov) et le coronavirus responsable du syndrome respiratoire du Middle Est en 2012 (MERS).
La majorité des formes de cette infection sont bénignes, ou asymptomatiques, mais elle donne aussi des pneumonies potentiellement graves. Si elle a été, au départ, considérée comme une maladie exclusivement respiratoire, il apparaît désormais qu’il s’agit aussi d’une maladie de système avec des thromboses et des atteintes vasculaires inflammatoires de « vascularite », et que d’autres organes sont largement touchés (cœur, vaisseaux, peau, système neurologique et digestif…).
Bien que bénigne chez la plupart des personnes (dans au moins 80% des cas), la maladie peut évoluer vers une pneumonie pouvant elle-même évoluer vers une forme grave dans 5% des cas : le syndrome de détresse respiratoire aigüe (SDRA) s’accompagnant d’un dysfonctionnement de plusieurs organes potentiellement létal (1,4% des cas) (35).
Aujourd’hui, l’intense activité de la recherche médicale et biologique nous permet d’en savoir un peu plus sur les mécanismes inflammatoires et immunitaires à l’origine du déclenchement des formes graves de la Covid-19. A la lecture de ces données scientifiques et influencé par nos connaissances dans le domaine des parodontopathies, il apparait de curieuses similitudes entre ces deux pathologies nous incitant à nous poser légitimement cette question : existerait-il une prédisposition entre maladies parodontales et Syndrome de détresse respiratoire aigu lié à la Covid-19 ?
1.Mécanisme inflammatoire de la Covid-19 : l’orage cytokinique, l’effet « auto-immun »
1.1. Le virus et sa « porte d’entrée »
Le SARS-Cov-2 est un β coronavirus utilisant le même récepteur cellulaire que le SARS-Cov : le récepteur de l’enzyme de conversion de l’Angiotensine 2. Les coronavirus sont classés en 4 groupes :
-Les α et β coronavirus touchent les mammifères (les α ont une pathogénicité faible, les β regroupant le deux SARS et le MERS peuvent engendrer une infection respiratoire potentiellement mortelle)
-Les γ et δ coronavirus touchent les oiseaux.
Le séquençage du génôme du SARS-Cov-2 est identique à 96,2% au CovRaTG13 de la chauve-souris ce qui laisse penser que le SARS-Cov-2 aurait pu être transmis à partir de la chauve-souris via un hôte intermédiaire.
Le SARS-Cov-2 est un coronavirus à ARN monobrin (Figure 1.) :
*2/3 de l’ARN code 16 protéines intrinsèquement désordonnées, c’est-à-dire des protéines possédant une forte plasticité pouvant donc interagir avec un grand nombre d’autres protéines.
*Le 1/3 restant code 4 protéines de structure essentielles (et plusieurs protéines accessoires) :
-Spike glycoprotein (S)
-Small Envelop protein (E)
-Matrix Protein (M)
-Nucleocapsid protein (N)
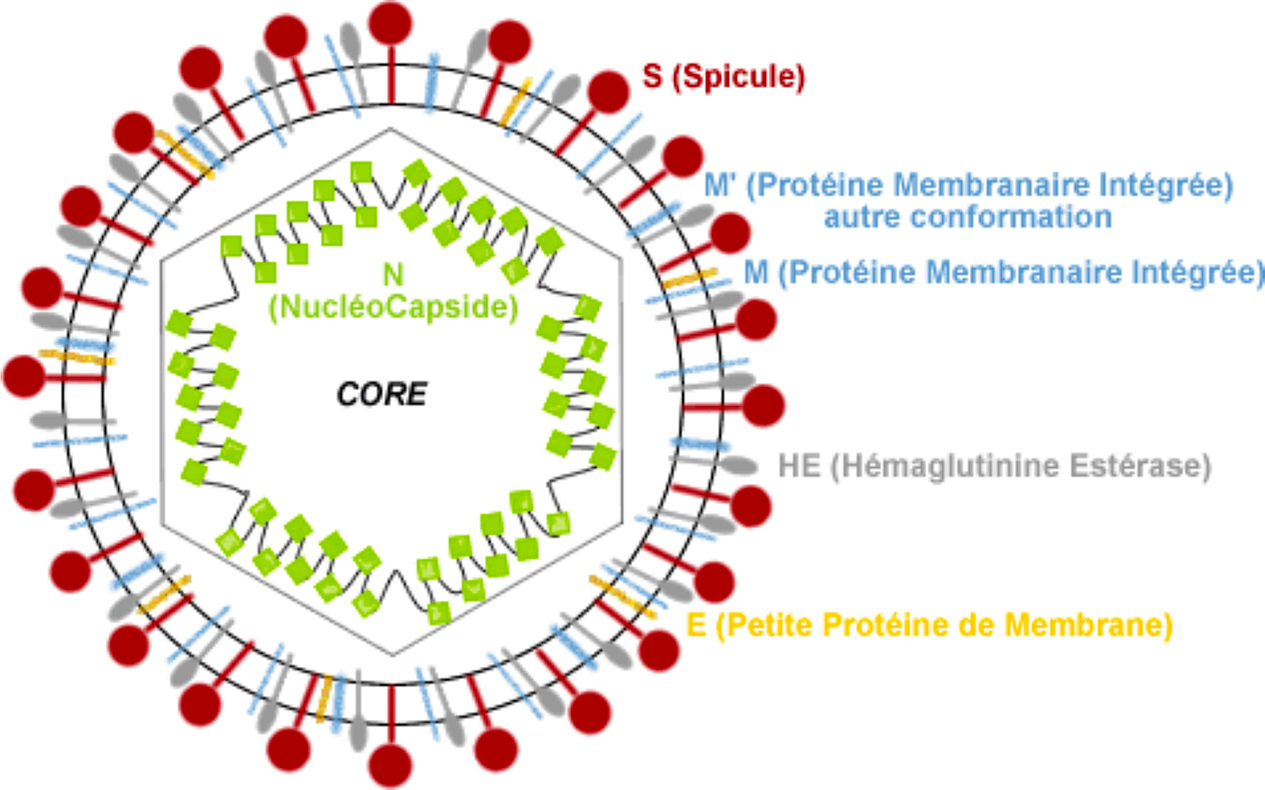
Figure 1 - Virus à ARN
La S glycoprotéine se lie aux récepteurs de la cellule hôte : les récepteurs de l’enzyme de conversion de l’Angiotensine 2 (ECA2). Ceci correspond à l’étape critique de l’entrée du virus.
L’action de molécules facilitant le passage de la membrane plasmique n’est pas encore clarifiée (19).
Les tissus cibles possédant un grand nombre de récepteurs à l’ECA2 peuvent donc être fortement atteints par le virus. (Poumons, intestin, rein, structures cérébrales et vaisseaux sanguins) (1) (Figure 2).
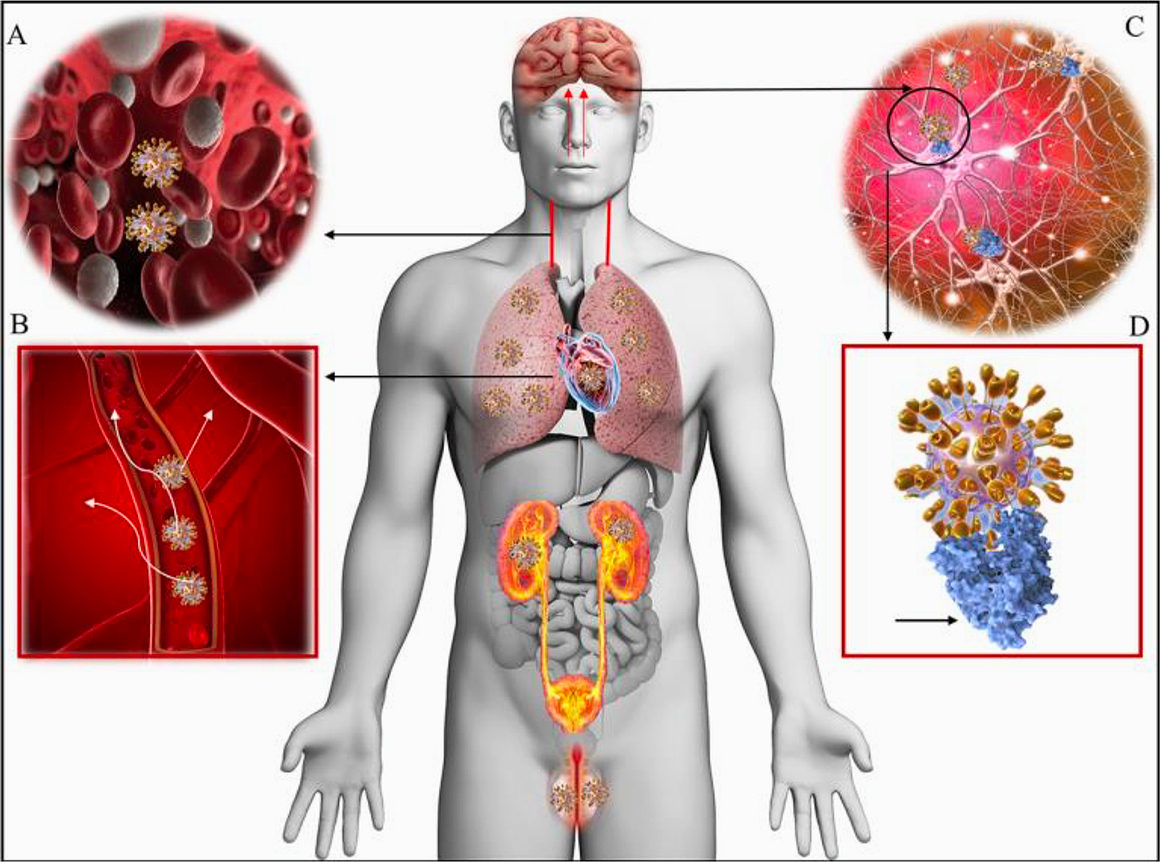
Figure 2 - Distribution des récepteurs ECA2 dans le corps humain (2)
1.2. Mécanisme inflammatoire à l’origine du syndrome respiratoire aigu.
Les études ont démontré un taux de cytokines et chimiokines pro-inflammatoires significativement élevé chez les patients atteints de Covid-19. (TNFα, Interleukines 1β et -6 en particulier) (26, 71, 27).
Comme lors d’une infection grippale sévère, l’orage de cytokine pourrait jouer un rôle majeur dans la pathologie immunitaire. Des études antérieures ont révélé que les cellules épithéliales pulmonaires, les macrophages et les cellules dendritiques expriment tous des cytokines durant une infection grippale par l’activation de récepteurs cibles (dont les récepteurs Toll : TLR3, TLR7 et TLR8).(27)
Cependant, la situation concernant le Covid-19 reste encore méconnue. Il est essentiel d'identifier la source principale de l’orage de cytokines en réponse à l'infection par le SRAS-CoV-2 et les mécanismes virologiques qui sont derrière.
Il apparait malgré tout que l’IL-6 jouerait un rôle prépondérant en initiant la réponse primaire à l’infection virale destinée à favoriser la clairance virale gérée par les neutrophiles.
Après cette phase pro-inflammatoire, la réponse immunitaire dérégulée se caractérise par un stade de suppression immunitaire. Elle se caractérise par une réduction soutenue et substantielle du nombre de lymphocytes périphériques, principalement des lymphocytes T CD4+ et CD8+ chez les patients COVID-19, et est associée à un risque élevé de développer une infection bactérienne secondaire. Cette condition, connue sous le nom de lymphopénie, est également retrouvée dans la grippe sévère et d'autres infections virales respiratoires. Il a été démontré que le degré de lymphopénie est en corrélation avec la gravité de COVID-19.(27)
Le SRAS-CoV-2 peut également attaquer les cellules endothéliales capillaires pulmonaires, ce qui conduit à une grande quantité d'exsudat de composants plasmatiques dans la cavité alvéolaire. En réponse à l'infection par le SRAS-CoV-2, les macrophages alvéolaires ou les cellules épithéliales pourraient produire diverses cytokines et chimiokines pro-inflammatoires. Ceci entraine l’arrivée de monocytes et de neutrophiles sur le site d'infection pour éliminer ces exsudats contenant des particules virales et des cellules infectées, entraînant une inflammation incontrôlée. Dans ce processus, en raison de la réduction substantielle du nombre et du dysfonctionnement des lymphocytes, la réponse immunitaire adaptative ne peut pas être initiée efficacement. L'infection virale incontrôlée entraîne une plus grande infiltration des macrophages et une aggravation supplémentaire des lésions pulmonaires. Pendant ce temps, l'attaque directe sur d'autres organes par le SRAS-CoV-2 disséminé, la pathogenèse immunitaire causée par la tempête systémique des cytokines et les dysfonctionnements de la microcirculation conduisent ensemble à une hypothèse de septicémie virale (27) (Figure 3).
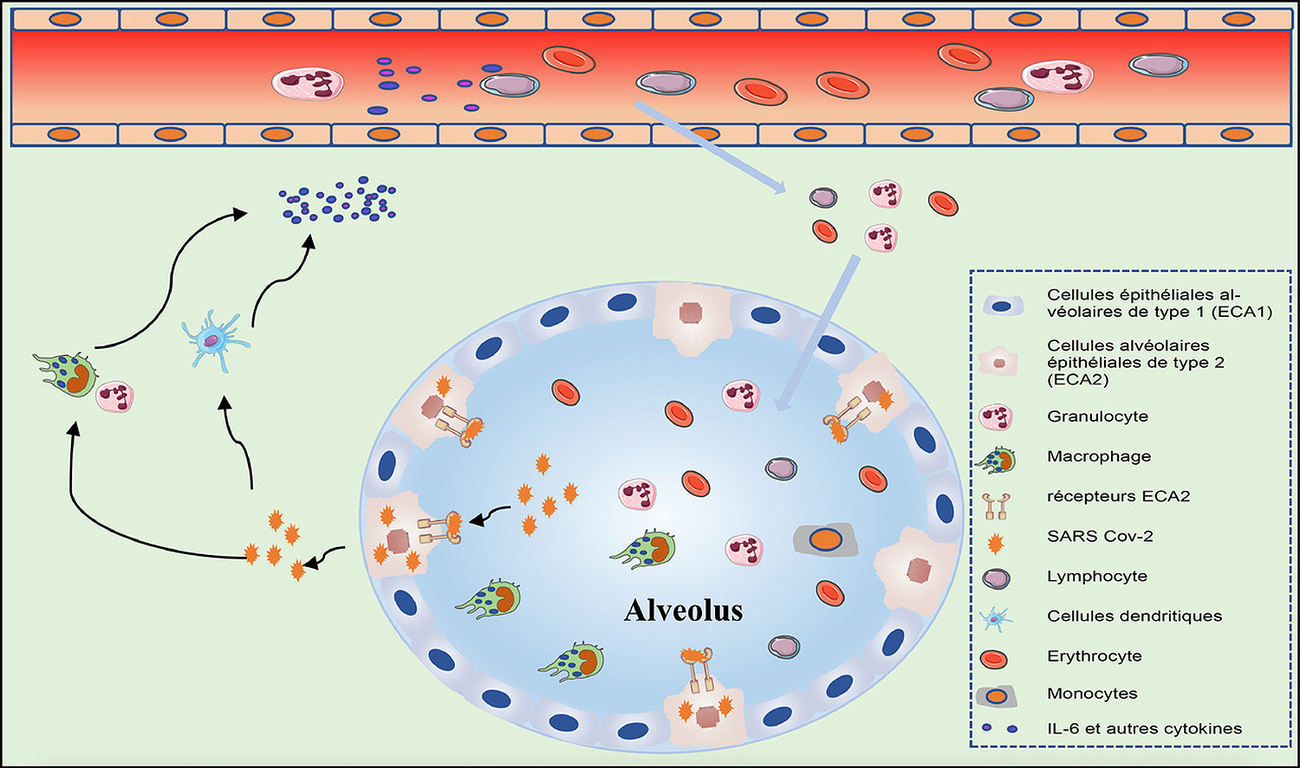
Figure 3 - Mécanisme possible de libération des cytokines au niveau alvéolaire chez les patients atteints de COVID-19 sévère.
Sur la base d'études antérieures sur le SRAS-CoV, les réponses inflammatoires de l'infection par le SRAS-CoV-2 sont séparées en réponse primaire (immunité innée) et réponse secondaire (immunité adaptative). Les réponses inflammatoires primaires (pro-inflammation) surviennent tôt après l'infection virale, avant l'apparition d'anticorps neutralisants. Ces réponses sont principalement motivées par une réplication virale active, une inhibition des récepteurs à l’ECA2 et une excrétion d’ECA2 à médiation virale. Les réponses inflammatoires secondaires commencent par la génération d'une immunité adaptative et la production d’anticorps. Le complexe virus-anticorps peut également déclencher des réponses inflammatoires induites par les Récepteurs Fc et des lésions pulmonaires aiguës. (33)
Il a été proposé que les anticorps anti-S chez les patients puissent potentiellement augmenter l'activité pro-inflammatoire des cellules exprimant les récepteurs Fc dans le poumon (comme les macrophages alvéolaires). La liaison des complexes immuns anticorps-virus aux récepteurs Fc activate les macrophages pulmonaires et induit l'expression de facteurs pro-inflammatoires tels que l'IL-8 et le MCP-1 qui s'ajoutent au milieu immunostimulant. De tels complexes peuvent également activer le système du complément conduisant à une nouvelle inflammation indésirable (Figure 4).
Figure 4. Mécanismes possibles des réponses inflammatoires engendrées par le SRAS-CoV-2.
2.Covid-19 et altération de coagulation.
Des études ont révélé que 71,4% des personnes décédées de COVID-19 montraient des résultats de coagulation anormaux au cours des stades ultérieurs de la maladie ; des concentrations particulièrement accrues de D-dimères et d'autres produits de dégradation de la fibrine significatifs de thromboses veineuses ou d’embolie pulmonaire (27).
Les mécanismes concrets de la coagulopathie ne sont pas encore identifiés. Il reste à déterminer si le SRAS-CoV-2 est capable d'attaquer directement les cellules endothéliales vasculaires exprimant des niveaux élevés d'ECA2, et de conduire ensuite à une coagulation et une septicémie anormales. En même temps, l'ECA2 est également un régulateur important de la pression artérielle. Une expression élevée d'ECA2 dans le système circulatoire après l'infection par le SRAS-CoV-2 pourrait contribuer partiellement à l'hypotension (27).
Une autre hypothèse plausible réside dans le rôle du microbiote intestinal commensal qui a récemment été impliqué dans les maladies cardiovasculaires (MCV) et les maladies cérébrovasculaires (4). La formation de plaques athérosclérotiques dépend du statut de colonisation de l'hôte. Une étude renforce cette hypothèse avec la production de Triméthylamine N-oxyde (TMAO) par le microbiote intestinal (74). Plusieurs études mentionnent par exemple la présence du genre Prevotella dans le syndrome de Lemierre, septicémie rare et sévère secondaire à une infection oropharyngée caractérisée par une thrombophlébite septique de la veine jugulaire interne avec des infections disséminées, les poumons étant la cible la plus fréquente (1, 65).
3.Population à risque : hypothèse bactérienne et microbiotes
3.1. Populations à risque
D’une manière générale, la population âgée est plus à risque de développer et de mourir du COVID-19. La comorbidité est présente dans plus de 30% des cas avec la COVID -19. À l'exception de moins de 1% du total, une maladie chronique a été trouvée dans tous les cas décédés de la COVID-19. Les hommes sont 1,5 fois plus susceptibles de mourir de la COVID -19 (54).
L'hypertension, le diabète, la Maladie Pulmonaire obstructive Chronique, les maladies cardiovasculaires et les maladies cérébro-vasculaires sont des facteurs de risque majeurs pour les patients atteints de COVID-19 (64).
Les traitements augmentant les taux d’Enzyme de conversion de l’Angiotensine 2 (ECA2) entraineraient un risque élevé d’infection sévère de la COVID-19 (anti-hypertenseurs inhibiteurs des récepteurs à l’ECA2 ou antagonistes des récepteurs de l’angiotensine, thiazolidinediones dans le traitement de diabète de type2 et ibuprofène) (38).
L’obésité constitue également un facteur de risque de la sévérité du Covid-19 (73, 38).
3.2. Lien entre microbiote intestinal, microbiote pulmonaire et réponse immunitaire
Un des points essentiels permettant une potentielle explication de la variabilité de la réponse immunitaire constatée entre les individus est le lien extrêmement étroit entre potentiel immunitaire et microbiote intestinal (32).
Il est désormais prouvé que le SARS-Cov2 infecte aussi les cellules épithéliales glandulaires gastro-intestinales. La détection positive d'ARN viral dans les matières fécales des patients COVID-19 confirme la libération des virions infectieux dans le tractus gastro-intestinal (66). D’autres études sont venues confirmer que les entérocytes pourraient constituer un réservoir cellulaire pour les coronavirus et que la quantité des récepteurs à ces particules virales pouvaient être conditionnés par la présence à la fois de bactéries invasives et de leur homologue, les probiotiques (16).
Le microbiote intestinal joue un rôle central dans la santé et les maladies humaines en façonnant le développement immunitaire, les réponses immunitaires et le métabolisme, et en protégeant des envahisseurs pathogènes. Les avancées techniques permettant une caractérisation complète des communautés microbiennes par séquençage génétique ont déclenché la chasse aux bactéries modulatrices de maladies. Des études émergentes chez l'homme ont lié l'abondance accrue d'espèces de Prevotella aux sites muqueux à des maladies localisées et systémiques, notamment la parodontite, la vaginose bactérienne, la polyarthrite rhumatoïde, les troubles métaboliques et l'inflammation chronique. L'augmentation de l'abondance de Prevotella est associée à une inflammation accrue des muqueuses. En effet, Prevotella stimule les cellules épithéliales pour produire IL-8, IL-6 et CCL20, ce qui peut favoriser les réponses immunitaires muqueuses des lymphocytes auxiliaires Th17 et le recrutement des neutrophiles.
L'inflammation des muqueuses provoquée par Prevotella entraîne une dissémination systémique des médiateurs inflammatoires, des bactéries et des produits bactériens, qui à leur tour peuvent affecter les résultats de la maladie systémique. Des études chez la souris soutiennent un rôle causal de Prevotella car les expériences de colonisation favorisent les caractéristiques cliniques et inflammatoires des maladies humaines. Par rapport aux bactéries commensales strictes, Prevotella présente des propriétés inflammatoires accrues, comme en témoigne la libération accrue de médiateurs inflammatoires à partir des cellules immunitaires et de diverses cellules stromales. Ces résultats indiquent que certaines souches de Prevotella peuvent être des agents des pathobiomes cliniquement importants qui peuvent participer aux maladies humaines en favorisant l'inflammation chronique (32).
Des études chez le modèle murin et chez l’être humain atteint de Syndrome de Détresse Respiratoire Aigu (SDRA) ont prouvé que le microbiome pulmonaire est enrichi en bactéries intestinales. L'analyse écologique a identifié le tractus gastro-intestinal inférieur, plutôt que les voies respiratoires supérieures, comme la communauté source probable de bactéries pulmonaires post-septicémie. Dans le liquide de lavage bronchoalvéolaire des humains atteints de SDRA, les bactéries spécifiques de l'intestin (Bacteroides spp.) étaient courantes et abondantes, non détectées par la culture et corrélées avec l'intensité de l'inflammation systémique. Le TNF-α alvéolaire, un médiateur clé de l'inflammation alvéolaire dans le SDRA, était significativement corrélé avec le microbiote pulmonaire altéré (13).
La relation entre microbiote pulmonaire et microbiote intestinal avait été déjà appréhendé par Beck, James et coll. en 2012. Cette étude avait pressenti qu’en plus de caractériser le microbiome pulmonaire, le microbiote du tractus gastro-intestinal a une profonde influence sur le développement et le maintien de l'immunité et de l'inflammation pulmonaires dans les cas de fibrose kystique, des maladies respiratoires du nouveau-né, de la maladie pulmonaire obstructive chronique et de l'asthme (5).
Enfin, même s’il faut rester prudent sur ce point, il est troublant d’avoir pu constater la présence du génôme du SARS-Cov2 dans le génôme du genre prevotella (3 études PCR par séquençage de l’ARN ribosomal 16S), comme si le virus était capable d’infiltrer un potentiel réservoir bactérien (10).
4. Liens avec les parodontites.
Les mécanismes d’apparition de la parodontite sont très étrangement comparables aux mécanismes conduisant à l’aggravation respiratoire du COVID-19.
4.1. Prévalence et populations à risque de parodontite.
Comme pour la Covid-19, un certain nombre de facteurs favorisants communs se retrouve dans la parodontite :
4.1.1. L’âge
Il est désormais acquis que la prévalence et la gravité des maladies parodontales augmentent avec l’âge. Par exemple, plus de 70% de la population américaine des plus de 65 ans présente une parodontite (selon l’Académie Américaine de parodontologie). La gravité accrue de la maladie parodontale et de la perte osseuse avec l'âge est probablement liée à la durée pendant laquelle les tissus parodontaux ont été exposés à la plaque bactérienne et est considérée comme reflétant les antécédents oraux cumulatifs de l'individu. De plus en plus d'études menées dans certains pays développés montrent des modèles de progression de la maladie parodontale liés à l’âge. Ces études ont montré que la destruction parodontale avancée et la perte osseuse sont rarement observées chez les personnes de moins de 40 ans. Une conclusion similaire a été observée même dans la population âgée. Des études chez les personnes âgées ont montré que les maladies parodontales avancées ne touchent qu'une petite fraction de ce groupe d'âge. Cependant, chez les personnes atteintes d'une maladie avancée, une dégradation supplémentaire se produit avec l'âge (68).
4.1.2. Le sexe
De nombreuses études ont rapporté une destruction parodontale plus élevée chez les hommes par rapport à la population féminine. Plusieurs hypothèses expliqueraient ce constat : l’hygiène buccale plus faible chez les hommes, l’apport d’oestrogènes chez la femme, un meilleur conditionnement immunitaire face à l’espèce Prevotella. Cependant, la relation observée entre le sexe et la maladie n'est pas apparente et n'est pas considérée comme forte et cohérente. Ainsi, le sexe peut être un facteur démographique, qui peut interférer avec les effets d'autres facteurs et il doit être contrôlé pour enquêter sur la maladie (68).
4.1.3. Le diabète.
Un des signes oraux importants du diabète est la gingivite et la parodontite. Les patients atteints de diabète sucré non diagnostiqué ou mal contrôlé de type 1 ou de type 2 sont plus à risque de maladie parodontale. De nombreuses études démontrent une association entre le diabète et une sensibilité accrue aux infections buccales, y compris les maladies parodontales. La parodontite progresse également plus rapidement chez les diabétiques mal contrôlés et l'âge précoce d'apparition de la maladie est considéré comme un facteur de risque de maladies plus sévères. À l'inverse, la plupart des patients diabétiques bien contrôlés peuvent maintenir une santé parodontale et répondront favorablement au traitement parodontal. Malgré des divergences sur cette question dans la littérature scientifique, il semble que l'effet du contrôle glycémique soit lié au mode de traitement parodontal. De nombreuses études ont traité de l'effet bénéfique du traitement parodontal sur le contrôle glycémique des patients diabétiques. (68)
4.1.4. L’obésité
L'obésité a été signalée comme un facteur de risque important de maladie parodontale. Plusieurs explications de l'association entre l'obésité et la maladie parodontale chez les jeunes adultes ont été fournies. La relation semble résider entre un faible apport alimentaire en calcium et en vitamine C. Les personnes qui consomment moins que l'apport nutritionnel recommandé (AJR) pour le calcium et la vitamine C ont des taux de maladie parodontale légèrement plus élevés. (68)
4.1.5. Maladies cardio-vasculaires et Hypertension artérielle.
L'élévation des niveaux de Protéïne C-réactive (CRP : marqueur de l’inflammation en lien avec le risque d’athérome) chez les personnes atteintes de parodontite indique que la parodontite peut également avoir des effets systémiques médiés par les cytokines qui peuvent à leur tour participer à l'athérogenèse. Cela peut expliquer les conditions dans lesquelles les infections dentaires peuvent stimuler la réponse inflammatoire systémique, exposant ainsi les personnes « apparemment en bonne santé » à un risque accru de maladies cardiovasculaires. (68)
S’ajoute à ce risque systémique, la preuve microbiologique directe d'un rôle contributif des infections parodontales dans l'étiologie de l'hypertension. (12)
4.2. Sur le plan immunitaire et inflammatoire :
La réponse immunitaire innée constitue un système homéostatique, qui est la première ligne de défense et est capable de reconnaître les micro-organismes envahisseurs comme étrangers, déclenchant des réponses immunitaires pour les éliminer. Les mécanismes effecteurs de l'immunité innée sont améliorés par l'immunité adaptative impliquant une boucle de défense pour la clairance microbienne dans la parodontite (56), pour la clairance virale dans le Covid-19. Le déclenchement de mécanismes innés appropriés assure une réponse immunitaire adaptative efficace, qui potentialise ces fonctions effectrices innées contre les bactéries parodontopathiques ou contre le SARS Cov-2.
Pour la parodontite comme pour l’infection virale au SARS-Cov2, l’IL-6, l’IL-1 et le TNF-α sont les cytokines dont le taux augmente le plus dans le contexte pro-inflammatoire. Sur le plan parodontal, la sécrétion de ces cytokines est favorisée par l’infection de la lignée monocytaire (macrophages et cellules dendritiques) par Porphyromonas Gingivalis, par le peptidoglycane de Treponema Denticola, et par les cellules épithéliales qui libèrent elles aussi ces cytokines (3) (Figure 4).
Parodontite et infection au SARS-Cov2 présentent une réponse immunitaire liée à la stimulation des Lymphocytes T auxiliaires (Th1, Th2, Th9, Th17 et Th22).
L’apparition de la maladie parodontale pourrait être liée à la dérégulation de cette réponse à médiation cellulaire (Figure 4).
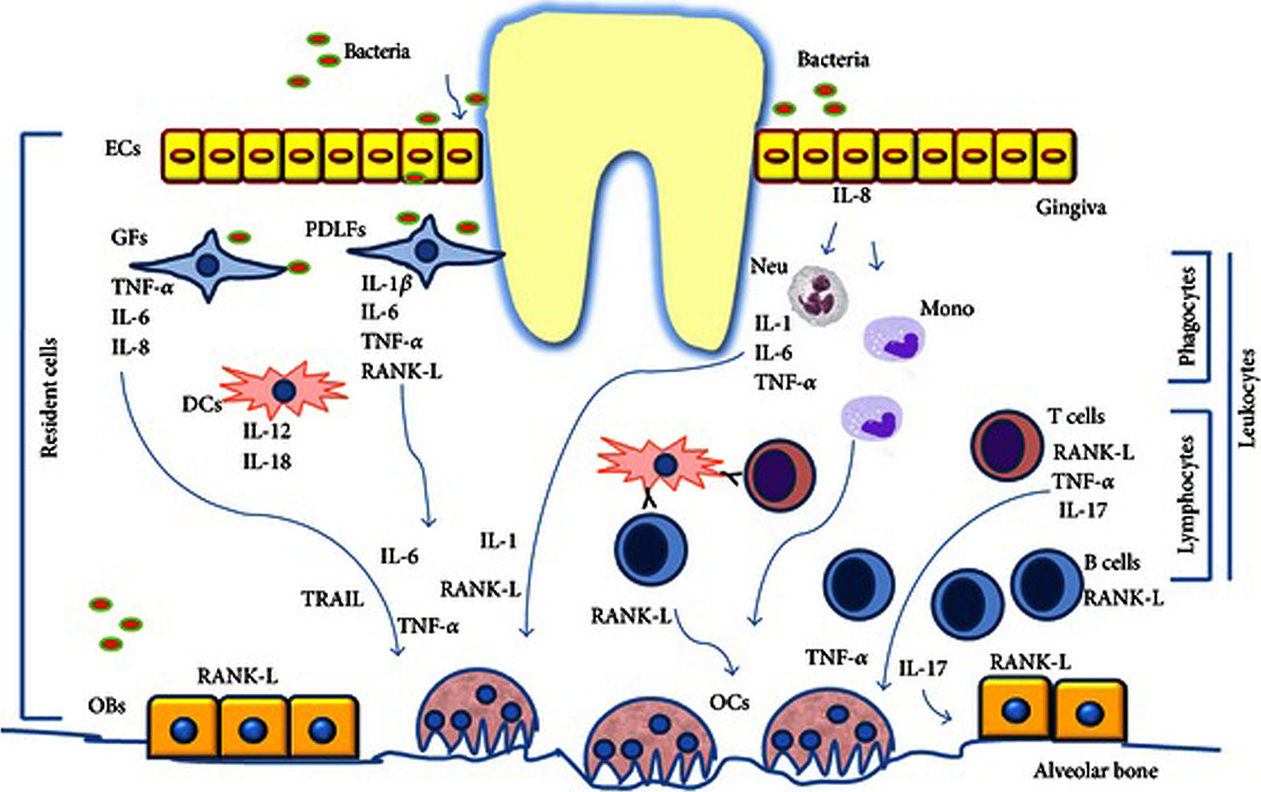
Figure 5. Réponse inflammatoire dans le cas des parodontites. (26)
La différenciation des monocytes précurseurs en ostéoclastes fait suite à la production du ligand enzymatique RANK-L (appelé aussi TNFsf11) par les lymphocytes CD4+ et les ostéoblates. Cette production fait suite à la stimulation par les cytokines (IL-6, IL-1β et TNF-α). L’IL-17 produites par les lymphocytes Th17 va également favoriser l’ostéoclasie et augmenter l’activation des cellules immunitaires d’où une production abondante de cytokines inflammatoires potentialisant l’effet ostéoclasique. (56)
La lymphopénie constatée dans l’infection au SARS-Cov2 ne permet pas l’initiation d’une réponse immunitaire adaptative. (Voir paragraphe 1.2)
Nous avons donc à faire à un système où la réponse protectrice de l'hôte se retourne contre ses propres tissus dans les deux cas.
Dans la parodontite, les cytokines (TNF et IL) se lient également aux récepteurs de surface des fibroblastes qui sécrètent alors des Prostaglandines (PG) et des métalloprotéinases matricielles (MMP). La sécrétion de MMP entraîne une destruction de la matrice, extracellulaire gingivale et desmodontale (7), tandis que les PG agissent en détruisant l’os alvéolaire.
La réponse innée est donc relativement spécifique et induit une réponse inflammatoire variable d’un sujet à l’autre (8). Ce constat concernant la parodontite est également valable pour la Covid-19.
4.2. Sur le plan bactérien
Le genre prevotella en lien potentiel avec l’aggravation de l’infection au SARS-Cov2 (comme évoqué dans les paragraphes 2 et 3.2.) est bien connu comme agent parodontopathogène avec notamment le Prevotella Intermedia.
La protéase ou la peptidase est l'un des principaux facteurs de pathogénicité de Prevotella intermedia. Outre son rôle dans la dégradation du tissu hôte, la protéolyse est également une partie importante de la voie de signalisation impliquée dans diverses pathologies, y compris les maladies inflammatoires. Des études antérieures ont montré que Prevotella intermedia dégrade les protéines telles que l'immunoglobuline et la protéine de liaison au LPS (LBP) pour entraver la défense de l'hôte (58).
Prevotella Intermedia provoque également la lyse des érythrocytes et la dégradation de l'hémoglobine, sa principale source de fer. Cette activité se retrouve pour Prevotella nigrescens et Prevotella pallens (58).
La dipeptidyl peptidase IV (DPP4) se retrouve également dans les trois souches de Prevotella intermedia. DPP4 est une protéase située à la surface de différentes cellules à travers les espèces, cette enzyme est codée par Prevotella intermedia 17 et 2 autres souches. Possédant une large gamme de substrats, le DPP4 est lié à divers processus physiologiques, notamment la régulation immunitaire, la transduction du signal et la cancérogenèse. Une étude antérieure a montré que la DPP4 de Prevotella gingivalis dans la gencive créviculaire est associée à sa pathogénicité et que Prevotella spp a également une forte activité DPP. Ces preuves indiquent un rôle important pour le DPP4 dans la pathogénicité (58).
Le Prevotella Intermedia est capable également d’inhiber la prolifération des lymphocytes B et T : effet immunosuppresseur (58).
Enfin, le Prevotella intermedia est en lien statistique avec les risques d’infarctus (25).
4.3. Microbiote bucco-dentaire et autres microbiomes (intestinal et pulmonaire) : influence de la parodontite (29)
Le premier constat d’évidence est que la cavité buccale est le point d'entrée des voies digestives et respiratoires. Plus de 700 espèces bactériennes peuvent être trouvées dans la cavité buccale des humains (46).
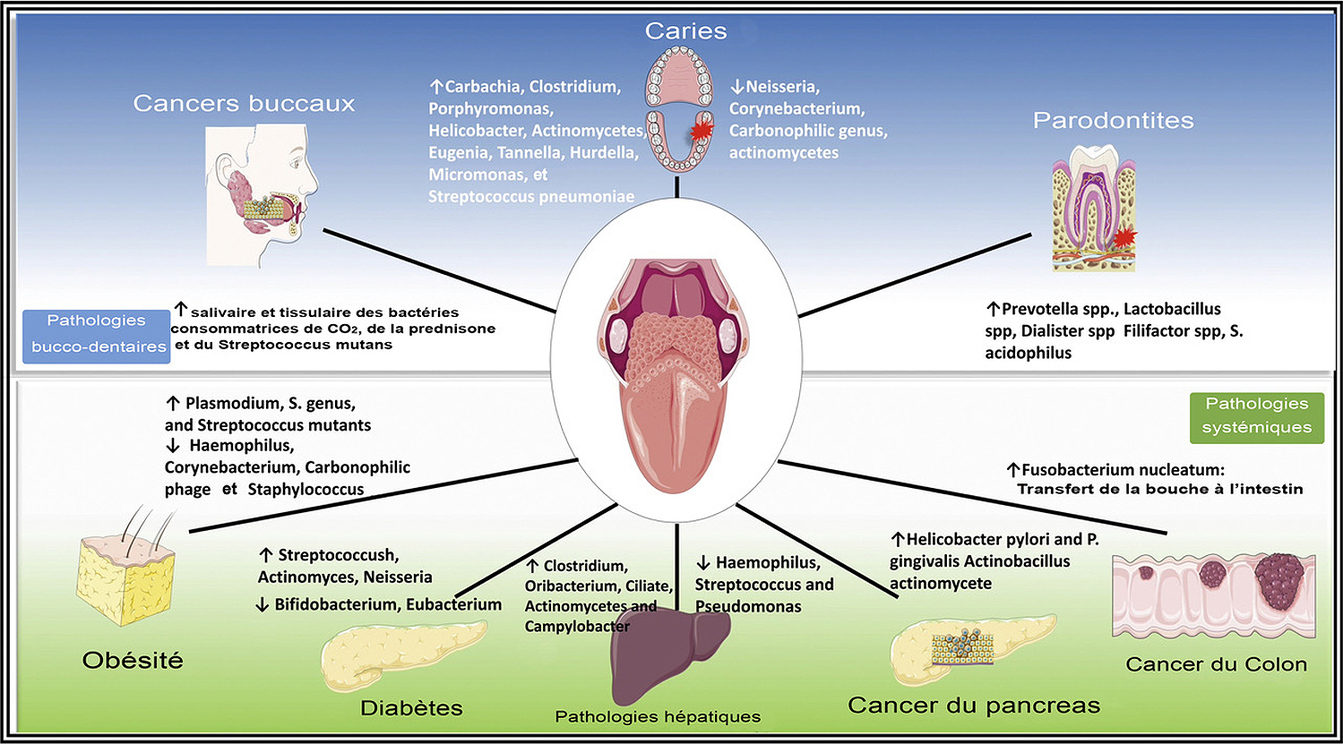
Figure 6. Le microbiote oral est lié aux maladies bucco-dentaires et systémiques (43)
4.3.1 Lien Systémique (Figure 6)
La dysbiose microbienne orale est liée à l'inflammation buccale et peut contribuer aux conditions systémiques par bactériémie (22).
Le lien entre les infections buccales et les conditions systémiques défavorables a attiré beaucoup d'attention dans la communauté des chercheurs. Plusieurs mécanismes ont été proposés, notamment la propagation de l'infection buccale due à une bactériémie transitoire entraînant une colonisation bactérienne dans des sites extra-oraux, une lésion systémique par des toxines libres issues d'agents pathogènes oraux et une inflammation systémique causée par des antigènes solubles d'agents pathogènes oraux. De plus en plus de preuves soutiennent un rôle majeur de la propagation systémique des commensaux oraux et des agents pathogènes vers des sites distants du corps provoquant des infections et une inflammation extra-buccales (22).
4.3.1.1. Maladies gastro-intestinales et microbiomes oraux
Il est désormais prouvé que de plus en plus de maladies du système gastro-intestinal sont associées aux microbiomes oraux. La maladie inflammatoire de l'intestin (MII : Maladie de Crohn et Colite ulcéreuse) est l'une des premières à avoir mis à jour ce lien. Il a été suggéré que la colonisation intestinale par des bactéries de la cavité buccale était largement impliquée dans ces maladies inflammatoires (47, 9). Parmi les pathologies buccales citées en lien avec ces maladies, nous retrouvons la stomatite aphteuse, l'ulcère buccal, la sécheresse de la bouche et la pyostomatite végétante. (28, 63), suggérant une association potentielle du microbiote oral avec de telles manifestations. Les genres dominants, Streptococcus, Prevotella, Neisseria, Haemophilus, Veillonella et Gemella, ont largement contribué à la dysbiose observée dans le microbiote salivaire des patients atteints de MII (24). Cette étude a également rapporté que la dysbiose observée était fortement associée à une réponse inflammatoire élevée de plusieurs cytokines avec du lysozyme appauvri dans la salive des patients atteints de MII, dont certaines montraient une forte corrélation avec l'abondance relative de certaines espèces bactériennes. Par exemple, il existe une forte corrélation entre les niveaux de lysozyme et d'IL-1β et l'abondance relative de Streptococcus, Prevotella, Haemophilus et Veillonella. Une autre étude a rapporté que la dysbiose observée dans les modèles murins de colite est associée à un changement de composition des bactéries présentes dans la cavité buccale et dans la salive (24, 41).
De nos jours, il existe des preuves plus convaincantes de corrélations entre la cirrhose du foie, les cancers gastro-intestinaux et les microbiomes oraux.
Dans la cirrhose du foie, 54% du microbiote intestinal est d’origine buccale (47). Le risque de cancer gastro-intestinal augmente chez les personnes atteintes de maladie parodontale ou de perte de dents, affections causées par des bactéries buccales (44, 50)
4.3.1.2. Maladies endocrines et microbiomes oraux
Les microbiomes oraux influencent et peuvent être influencés par l'environnement interne individuel, ce qui nous éclaire pour trouver des corrélations entre les maladies du système endocrinien et les microbiomes oraux.
Il existe une relation bidirectionnelle entre la maladie parodontale et le diabète. Le microbiome joue un rôle clé dans l'homéostasie et affecte plusieurs processus pathologiques, dont le diabète (62).
Le diabète est un facteur de risque de parodontite et la parodontite augmente la gravité du diabète.
Les accouchements prématurés se sont révélés être associés à des modifications du microbiome oral. Madianos et al. (42), ont constaté que les mères avaient des niveaux significativement plus élevés de Bacteroides forsythus et Campylobacter rectus. Ensuite, F. nucleatum, qui est associée à une maladie parodontale, est également associée aux accouchements prématurés. F. nucleatum peut être transmis de manière hématogène au placenta et entraîner des issues de grossesse défavorables (21, 20). La réponse inflammatoire systémique déclenchée peut exacerber les réponses inflammatoires locales au niveau de l'unité fœto-placentaire et augmenter encore le risque d'accouchement prématuré (42).
L'obésité a également été associée au microbiome oral. La nature inflammatoire de l'obésité étant largement reconnue, Goodson et al. (18) ont trouvé la composition des changements de bactéries salivaires chez les femmes en surpoids. Les espèces bactériennes pourraient servir d'indicateurs biologiques du développement d'une surcharge pondérale. Les bactéries orales peuvent participer à la pathologie qui mène à l'obésité (18).
Le syndrome des ovaires polykystiques (SOPK) est une affection endocrinienne féminine courante d'étiologie peu claire caractérisée par l'hyperandrogénie, l'aménorrhée et la morphologie ovarienne polykystique, souvent compliquée par l'infertilité, l'obésité, la résistance à l'insuline et l'inflammation de bas grade. Le microbiome intestinal est connu pour contribuer à plusieurs de ces conditions. Récemment, une association entre les selles et les profils des communautés de microbiomes salivaires a été mise en évidence (39). Les patients atteints de SOPK ont montré une diminution des bactéries du phylum Actinobacteria et un changement significatif limite dans la composition de la communauté bactérienne.
4.3.1.3. Maladies du système immunitaire
Les microbiomes oraux sont fortement liés aux fonctions du système immunitaire humain, sont donc en corrélation avec les maladies du système immunitaire humain comme la polyarthrite rhumatoïde (PR) et font la différence sur les performances des maladies multisystèmes dans le système immunitaire, telles que l'infection par le virus de l'immunodéficience humaine (VIH).
Des déclencheurs microbiens ont été impliqués dans la PR (72). Une concordance a été observée entre les microbiomes intestinal et oral, suggérant un chevauchement dans l'abondance et la fonction des espèces à différents sites corporels. La dysbiose a été détectée dans les microbiomes intestinaux et oraux des patients atteints de PR, mais elle a été partiellement résolue après le traitement de la PR. Les altérations du microbiome intestinal, dentaire ou salivaire ont distingué les individus atteints de PR des indidividus sains, et ont été corrélées avec des mesures cliniques. Ces données pourraient être utilisées pour classifier les individus en fonction de leur réponse au traitement.
Dans le cas du VIH, une virémie élevée chez les patients non traités est associée à des proportions significativement plus élevées d'espèces de Veillonella, Prevotella, Megasphaera et Campylobacter potentiellement pathogènes que chez les témoins sains (11).
4.3.1.4. Maladies du Système cardio-vasculaire
Les chercheurs ont prouvé certains liens potentiels entre l'athérosclérose et les microbiomes oraux.
L'athérosclérose se caractérise par une accumulation de cholestérol et le recrutement de macrophages dans la paroi artérielle. Elle peut donc être considérée à la fois comme une maladie métabolique et une maladie inflammatoire (23, 30). Par séquençage de l'ARNr 16S, Koren et al. (30) ont identifié Chryseomonas, Veillonella et Streptococcus dans la majorité des mocrobiomes oraux des patients athérosclérotiques. De plus, plusieurs phylotypes bactériens supplémentaires étaient communs à la plaque d'athérosclérose et aux échantillons oraux ou intestinaux d'un même individu. Fait intéressant, plusieurs taxons bactériens dans la cavité buccale et l'intestin étaient en corrélation avec les niveaux de cholestérol plasmatique. Les bactéries de la cavité buccale, et peut-être même de l'intestin, peuvent être en corrélation avec les marqueurs de la maladie de l'athérosclérose (30, 37).
4.3.2. Lien Ectopique
4.3.2.1. Colonisation intestinale par les voies digestives
La colonisation intestinale par des bactéries d'origine orale a été corrélée à plusieurs résultats négatifs pour la santé, notamment la maladie inflammatoire de l'intestin. Cependant, le rôle causal des bactéries orales colonisant ectopiquement l'intestin reste incertain. En utilisant des techniques gnotobiotiques, nous montrons que des souches de Klebsiella spp. isolés du microbiote salivaire sont de puissants inducteurs des cellules T helper 1 (TH1) lorsqu'elles colonisent l'intestin. Ces souches de Klebsiella sont résistantes à plusieurs antibiotiques, ont tendance à coloniser le microbiote intestinal lorsqu’il est dysbiotique et provoquent une grave inflammation intestinale dans le contexte d'un hôte génétiquement sensible. Nos résultats suggèrent que la cavité buccale peut servir de réservoir pour des pathobiotes intestinaux potentiels qui peuvent exacerber les maladies intestinales. (29)
4.3.2.2. Maladie parodontale et maladies pulmonaires (31)
Alors que la pneumonie peut être causée par une infection par une bactérie, un virus, un champignon ou un parasite, le type le plus courant est la pneumonie bactérienne. En règle générale, les voies respiratoires inférieures sont protégées des micro-organismes par le réflexe de la toux, le mouvement ciliaire des cellules de la muqueuse et les médiateurs immunitaires innés (34), qui sont capables de disperser les bactéries salivaires aspirées pendant le sommeil ou la déglutition accidentelle. Cependant, une altération de ces défenses (comme dans le tabagisme de long terme, le diabète, la maladie pulmonaire obstructive chronique ou l'immunosuppression, ou comme pendant l'intubation ou un séjour hospitalier post-opératoire prolongé) peut entraîner une pneumonie nosocomiale (61, 57). Des études transversales ont démontré que chez les patients dentés, une mauvaise hygiène bucco-dentaire et le non-respect des visites d'hygiène dentaire augmentent le risque de développer une pneumonie, indiquant que les pathobiontes buccaux peuvent être un lien potentiel entre les maladies bucco-dentaires et pulmonaires (60). Il a été démontré que les patients hospitalisés souffrant de pneumonie hébergent les pathogènes respiratoires Klebsiella pneumoniae, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, Haemophilus influenzae et H. parainfluenzae (55, 51, 53), tandis que des agents pathogènes parodontaux, par exemple P. gingivalis, F. nucleatum, Prevotella oralis, Campylobacter gracilis, Fusobacterium necrophorum et Aggregatibacter actinomycetemcomitans, ont été identifiés dans les sécrétions pulmonaires de sujets atteints de pneumonie (68, 69, 40, 60). De plus, le traitement parodontal et l'amélioration de l'hygiène buccale ont diminué l'incidence de la pneumonie chez les enfants et les adultes hospitalisés (67,54).
Les études examinées ci-dessus et plusieurs autres ont suggéré que les bactéries buccales peuvent provoquer des maladies respiratoires lorsque :
Des bactéries buccales ou des agents pathogènes respiratoires des réservoirs buccaux sont aspirés dans les voies respiratoires inférieures,
Des enzymes salivaires libérées pendant une maladie parodontale chronique ou le tabagisme modifient la muqueuse buccale et conduisent à une adhérence accrue par des agents pathogènes respiratoires,
Et / ou des cytokines pro-inflammatoires circulantes libérées à la suite d'une inflammation parodontale modifient la muqueuse respiratoire (36, 44).
5. CONCLUSIONS
Le recoupement de ces données vise à établir un lien éventuel entre les parodontopathies et le déclenchement du syndrôme de détresse respiratoire aigüe.
Les liens possibles concernent d’abord le microbiote pathologique parodontal favorisant la dissémination systémique des bactéries (Bactériémie). Cette bactériémie explique nombre de pathologies dont curieusement certaines constituent les facteurs de comorbidité du Covid-19 (personnes âgées, diabète, obésité, athérosclérose...). Cette bactériémie engendrant des réponses inflammatoires chroniques va également favoriser la dissémination systémique des médiateurs inflammatoires se rajoutant ainsi à ceux issus de la réponse à la réplication virale. On pourrait ainsi y voir une contribution à l’emballement inflammatoire des cytokines en lien avec le SDRA.
Le microbiote du tractus gastro-intestinal a une profonde influence sur le développement et le maintien de l'immunité. Cette bactériémie d’origine parodontale est également capable d’engendrer une dysbiose intestinale à l’origine d’un affaiblissement de la réponse immunitaire (ce qui explique en sens inverse que la dysbiose intestinale peut favoriser la parodontite) tout comme la bactériémie d’origine parodontale ainsi que la dysbiose intestinale peuvent engendrer la dysbiose pulmonaire.
Si on rajoute à cela l’aspiration pulmonaire des bactéries buccales (le transfert ectopique), connaissant aujourd’hui le lien entre pneumonies et germes parodontaux pathogènes, le nombre de recoupement entre maladies parodontales et SDRA peut laisser entrevoir de possibles liens.
Enfin, un des derniers éléments cliniques en faveur de cette idée pourrait être l’utilisation de l’Azythromycine parmi les traitements proposés au SDRA du Covid-19. Si les études cliniques confirment prochainement le bien-fondé de l’utilisation de cet antibiotique bien connu des parodontistes (14), l’hypothèse présentée ci-dessus pourrait y trouver un argument supplémentaire.
Sur la base de ces données, reste à confirmer le recoupement de ces données par une évaluation d’abord clinique. Il serait désormais souhaitable de corréler statistiquement des données parodontales préexistantes (imagerie, tests ADN) chez les patients ayant développé une symptomatologie sévère du Covid-19 ou chez les patients décédés du Covid-19. S’il s’avérait que ces données soit statistiquement prouvées, nous aurions alors un argument de plus dans l’intérêt de la prévention bucco-dentaire et la prise en charge thérapeutique de la parodontite. Dans ce domaine, l’intérêt des traitements lasers assistés prend une dimension cruciale par les effets bactéricides de la Photothérapie dynamique (PDT). Le protocole associant Peroxyde d’hydrogène à 3% et laser permet une diminution bactérienne de 99,95 % à 100% (49). De fait la bactériémie, l’ensemble de ses effets systémiques ainsi que le transfert ectopique oral sont alors complètement annihilés.
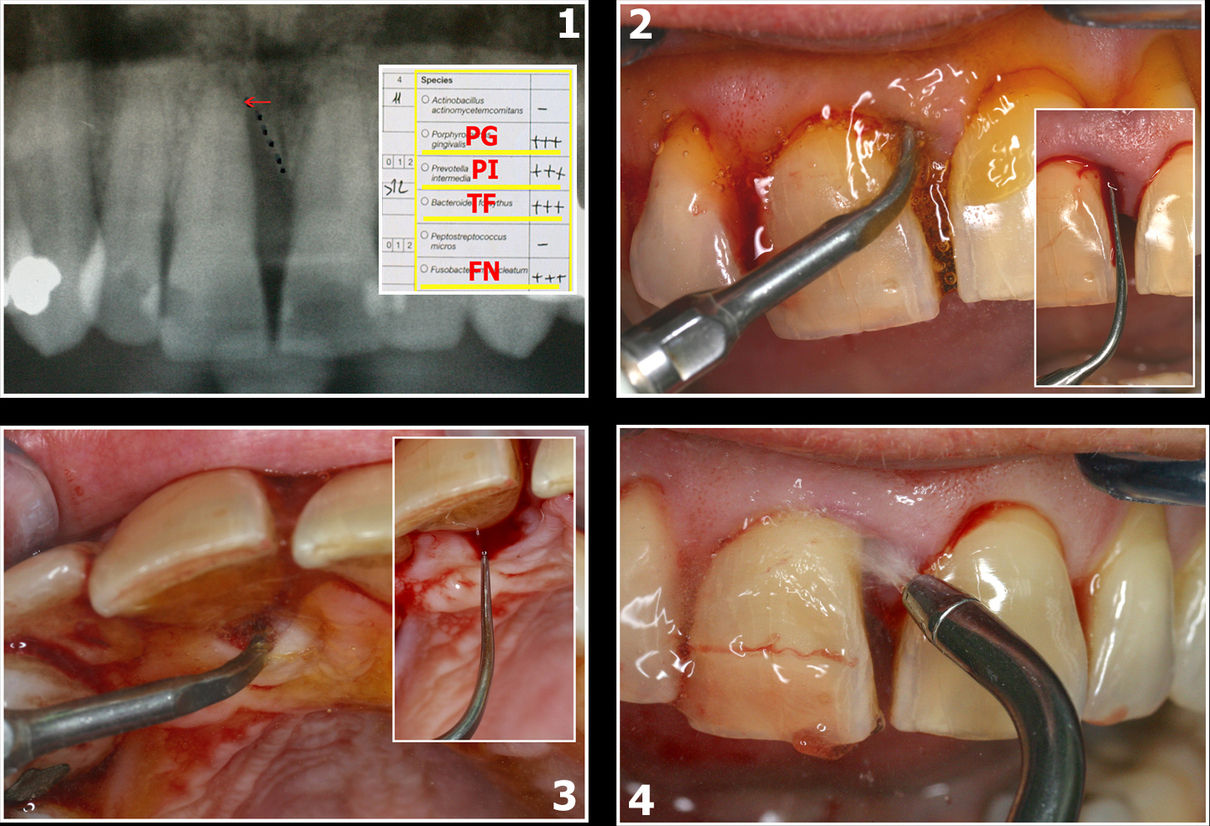
Fig.7 : 1 : État radiographique initial
2, 3 et 4 : Préparation parodontale initiale
Suivant protocole Dr REY
Et Bactériologiques
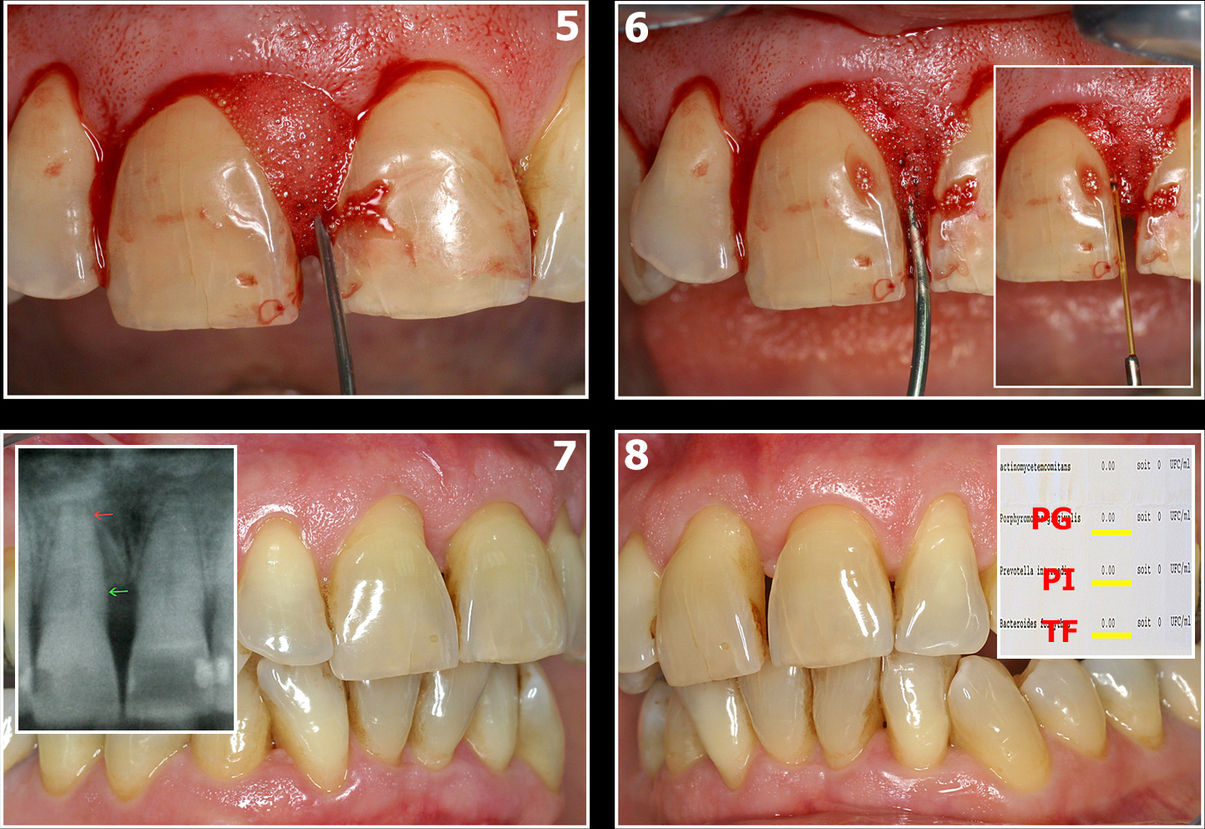
Fig.8
Fig.8 : 5 : Oxygénation
6 : PDT sans colorant avec laser Diode
7 et 8 : Résultats cliniques radiographiques
Le cas clinique illustré sur les images 7 et 8 montre le traitement d’une parodontite avec forte présence de Prevotella Intermedia (P.I.) ainsi que les bactéries du complexe rouge de Socransky, Porphyromonas Gingivalis et Tannarella Forsyhtia.
Une seule séance de traitement lasers assisté a permis (sans antibiotique) de supprimer les pathogènes responsables de cet abcès (cas clinique G. Rey).
La maitrise et la surveillance de l’hygiène buccodentaire favoriseront une excellente cicatrisation gingivale et osseuse (fig. 8 : 7 et 8). La vérification bactériologique montre une flore totalement compatible avec le maintien des volumes osseux reconstitués.
Enfin, si le lien d’une prédisposition réelle entre parodontite et aggravation respiratoire et thromboembolique du Covid-19 s’avérait significatif, nous disposerions alors d’un critère objectif et simple de protection de personnes à risque.
BIBLIOGRAPHIE
- A. Garza-Alatorreand al. Atypical Lemierre's syndrome caused by Prevotella oris,Medicina Universitaria,Volume 17, Issue 69,2015,Pages 218-221,ISSN 1665-5796,https://doi.org/10.1016/j.rmu.2015.09.002.
- Abdul Mannan Baig, Areeba Khaleeq, Usman Ali, and Hira Syeda. Evidence of the COVID-19 Virus Targeting the CNS: Tissue Distribution, Host–Virus Interaction, and Proposed Neurotropic Mechanisms. ACS Chemi Neuroscience 2020 11 (7), 995-998. DOI: 10.1021/acschemneuro.0c00122
- Anilei Hoare,1 Cristopher Soto,1 Victoria Rojas-Celis,1 and Denisse Bravo. Chronic Inflammation as a Link between Periodontitis and Carcinogenesis. Specail Issue Inflammatory Mediators in Periodontal Pathogenesis. Volume 2019 |Article ID 1029857 | 14 pages | https://doi.org/10.1155/2019/1029857
- Ascher, S. and Reinhardt, C. (2018), The gut microbiota: An emerging risk factor for cardiovascular and cerebrovascular disease. Eur. J. Immunol., 48: 564-575. doi:10.1002/eji.201646879.
- Beck, James M et al. “The microbiome of the lung.” Translational research : the journal of laboratory and clinical medicine vol. 160,4 (2012): 258-66. doi:10.1016/j.trsl.2012.02.005
- Benedetto, Adriana & Gigante, Isabella & Colucci, Silvia & Grano, Maria. (2013). Periodontal Disease: Linking the Primary Inflammation to Bone Loss. Clinical & developmental immunology. 2013. 503754. 10.1155/2013/503754.
- Birkedal‐Hansen, H. (1993), Role of Matrix Metalloproteinases in Human Periodontal Diseases. Journal of Periodontology, 64: 474-484. doi:10.1902/jop.1993.64.5s.474
- Bouchard P. Parodontologie et dentisterie implantaire, Vol-1 Médecine Parodontale. Paris 2014 Editions Lavoisiers.
- Caballero S, Pamer EG. Microbiota-mediated inflammation and antimicrobial defense in the intestine. Annu Rev Immunol. 2015;33:227-56. doi:10.1146/annurev-immunol-032713-120238. Epub 2015 Jan 2. Review. PubMed PMID:25581310; PubMed Central PMCID: PMC4540477.
- Chakraborty, Sandeep. (2020). The 2019 Wuhan outbreak is caused by the bacteria Prevotella, which is aided by the coronavirus, possibly to adhere to epithelial cells - Prevotella is present in huge amounts in patients from both China and Hong Kong. 10.31219/osf.io/usztn.
- Dang AT, Cotton S, Sankaran-Walters S, Li CS, Lee CY, Dandekar S, Paster BJ, George MD. Evidence of an increased pathogenic footprint in the lingual micro- biome of untreated HIV infected patients. BMC Microbiol. 2012;12:153.
- Desvarieux M, Demmer RT, Jacobs DR Jr, et al. Periodontal bacteria and hypertension: the oral infections and vascular disease epidemiology study (INVEST). J Hypertens. 2010;28(7):1413‐1421. doi:10.1097/HJH.0b013e328338cd36
- Dickson, R., Singer, B., Newstead, M. et al. Enrichment of the lung microbiome with gut bacteria in sepsis and the acute respiratory distress syndrome. Nat Microbiol 1, 16113 (2016). https://doi.org/10.1038/nmicrobiol.2016.113
- Eun-YoungChoia, Ji-YoungJina, Jeom-IlChoibc, In SoonChoia, Sung-JoKim. Effect of azithromycin on Prevotella intermedialipopolysaccharide-induced production of interleukin-6 in murine macrophages. European Journal of Pharmacology. Volume 729, 15 April 2014, Pages 10-16
- Fang, Lei et al. Are patients with hypertension and diabetes mellitus at increased risk for COVID-19 infection? The Lancet Respiratory Medicine, Volume 8, Issue 4, e21
- Feng, Z.; Wang, Y.; Qi, W. The Small Intestine, an Underestimated Site of SARS-CoV-2 Infection: From Red Queen Effect to Probiotics. Preprints 2020, 2020030161 (doi: 10.20944/preprints202003.0161.v1).
- Gao, Lu et al. “Oral microbiomes: more and more importance in oral cavity and whole body.” Protein & cell vol. 9,5 (2018): 488-500. doi:10.1007/s13238-018-0548-1
- Goodson JM, Groppo D, Halem S, Carpino E. Is obesity an oral bacterial disease? J Dent Res. 2009;88(6):519–523.
- Guo YR, Cao QD, Hong ZS, et al. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak - an update on the status. Mil Med Res. 2020;7(1):11. Published 2020 Mar 13. doi:10.1186/s40779-020-00240-0
- Han YW, Fardini Y, Chen C, Iacampo KG, Peraino VA, Shamonki JM, Redline RW. Term stillbirth caused by oral Fusobacterium nucleatum. Obstet Gynecol. 2010;115(2 Pt 2):442.
- Han YW, Wang X. J. Mobile microbiome: oral bacteria in extra-oral infections and inflammation. Dent Res. 2013 Jun;92(6):485-91. doi: 10.1177/0022034513487559. Epub 2013 Apr 26.
- Han YW, Redline RW, Li M, Yin L, Hill GB, McCormick TS. Fusobacterium nucleatum induces premature and term stillbirths in pregnant mice: implication of oral bacteria in preterm birth. Infect Immunity. 2004;72(4):2272–2279
- Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med. 2005;352:1685–1695.
- Heba S. Said, Wataru Suda, Shigeki Nakagome, Hiroshi Chinen, Kenshiro Oshima, Sangwan Kim, Ryosuke Kimura, Atsushi Iraha, Hajime Ishida, Jiro Fujita, Shuhei Mano, Hidetoshi Morita, Taeko Dohi, Hiroki Oota, Masahira Hattori, Dysbiosis of Salivary Microbiota in Inflammatory Bowel Disease and Its Association With Oral Immunological Biomarkers, DNA Research, Volume 21, Issue 1, February 2014, Pages 15–25, https://doi.org/10.1093/dnares/dst037
- Hirofumi Soejima, Yoko Oe, Hideki Nakayama, Katsuhiko Matsuo, Takashi Fukunaga, Koichi Sugamura, Hiroaki Kawano, Seigo Sugiyama, Masanori Shinohara, Yuichi Izumi, Hisao Ogawa. Periodontal status and Prevotella intermediaantibody in acute coronary syndrome. International Journal of Cardiology. Volume 137, Issue 3, November–December 2009, Pages 304-306
- Huang, C., et al., Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 2020. 395(10223): p. 497-506.
- Hui Li, Liang Liu, Dingyu Zhang, Jiuyang Xu, Huaping Dai, Nan Tang, Xiao Su, Bin Cao. SARS-CoV-2 and viral sepsis: observations and hypotheses,The Lancet,2020,ISSN 0140-6736, https://doi.org/10.1016/S0140-6736(20)30920-X.
- Jose FA, Heyman MB. Extraintestinal manifestations of inflammatory bowel disease. J Pediatr Gastroenterol Nutr. 2008 Feb;46(2):124-33. doi:10.1097/MPG.0b013e318093f4b0. Review. PubMed PMID: 18223370; PubMed Central PMCID: PMC3245880.
- Koji Atarashi and al, Ectopic colonization of oral bacteria in the intestine drives TH1 cell induction and inflammation. SCIENCE20 OCT 2017 : 359-365
- Koren O, Spor A, Felin J, Fåk F, Stombaugh J, Tremaroli V, Behre CJ, Knight R, Fagerberg B, Ley RE, et al. Human oral, gut, and plaque microbiota in patients with atherosclerosis. Proc Natl Acad Sci. 2011;108(Supplement 1):4592–4598.
- Kumar, P.S. (2017), From focal sepsis to periodontal medicine: a century of exploring the role of the oral microbiome in systemic disease. J Physiol, 595: 465-476. doi:10.1113/JP272427
- Larsen, J.M. (2017), The immune response to Prevotella bacteria in chronic inflammatory disease. Immunology, 151: 363-374. doi:10.1111/imm.12760
- Laurent Renia, Lisa F.P. Ng, Paul A Macary, Matthew Tay, Chek Meng Poh. COVID-19 Science Report: Pathogenesis and Host Immune Response to SARS-CoV-2. (Department of Microbiology and Immunology Yong Loo Lin Scholl of Medicine).
- Levison ME (1994). Pneumonia, including necrotizing pulmonary infections (lung abscess). In Harrison's Principles of Internal Medicine, 13th edn, ed. Isselbacher KJ, Braunwald E, Wilson JD et al., pp. 1197–1206. McGraw Hill, New York.
- Li H, Liu L, Zhang D, Xu J, Dai H, Tang N, Su X, Cao B. SARS-CoV-2 and viral sepsis: observations and hypotheses. Lancet. 2020 Apr 17. Pii; S0140-6736(20)30920-X. doi: 10.1016/S0140-6736(20)30920-X.
- Li X, Kolltveit KM, Tronstad L & Olsen I (2000). Systemic diseases caused by oral infection. Clin Microbiol Rev 13, 547–558.
- Libby P, Ridker PM, Maseri A. Inflammation and atherosclerosis. Circulation. 2002;105(9):1135–1143
- Lighter J, Phillips M, Hochman S, et al. Obesity in patients younger than 60 years is a risk factor for Covid-19 hospital admission [published online ahead of print, 2020 Apr 9]. Clin Infect Dis. 2020;ciaa415. doi:10.1093/cid/ciaa415
- Lindheim L, Bashir M, Münzker J, Trummer C, Zachhuber V, Pieber TR, Gorkiewicz G, Obermayer-Pietsch B. The salivary microbiome in polycystic ovary syndrome (PCOS) and its association with disease-related parameters: a pilot study. Front Microbiol. 2016;7:1270.
- Lorenz KA & Weiss PJ (1994). Capnocytophagal pneumonia in a healthy man. West J Med 160, 79–80.
- Lucas López, R, Grande Burgos, MJ, Gálvez, A, Pérez Pulido, R. The human gastrointestinal tract and oral microbiota in inflammatory bowel disease: a state of the science review. APMIS 2017; 125: 3– 10.
- Madianos PN, Bobetsis YA, Offenbacher S. Adverse pregnancy outcomes (APOs) and periodontal disease: pathogenic mechanisms. J Clin Periodontol. 2013;40(s14):181–194
- Meurman J. Oral microbiota and cancer. J Oral Microbiol. 2010;2:1–10.
- Paju S & Scannapieco FA (2007). Oral biofilms, periodontitis, and pulmonary infections. Oral Dis 13, 508–512.
- Paster BJ, Olsen I, Aas JA, Dewhirst FE. The breadth of bacterial diversity in the human periodontal pocket and other oral sites. Periodontol 2000. 2006;42:80-7. Review
- Pickard, JM, Zeng, MY, Caruso, R, Núñez, G. Gut microbiota: Role in pathogen colonization, immune responses, and inflammatory disease. Immunol Rev. 2017; 279: 70– 89. https://doi.org/10.1111/imr.12567
- Qin N, Yang F, Li A, Prifti E, Chen Y, Shao L, Guo J, Le Chatelier E, Yao J, Wu L, et al. Alterations of the human gut microbiome in liver cirrhosis. Nature. 2014;513(7516):59–64.
- REY G. L’apport du laser dans le traitement des poches parodontales. Implantodontie 2° trim. 2000 ; n°38 : 27-34
- Rogers AB, Fox JG. Inflammation and cancer. I. Rodent models of infectious gastrointestinal and liver cancer. Am J Physiol Gastrointest Liver Physiol. 2004;286:G361–G366.
- Russell SL, Boylan RJ, Kaslick RS, Scannapieco FA & Katz RV (1999). Respiratory pathogen colonization of the dental plaque of institutionalized elders. Spec Care Dentist 19, 128–134.
- Rey G, Missika P. Traitements parodontaux et lasers en Omnipratique dentaire – La simplicité efficace. Elsevier Masson, Coll. Techniques dentaires 2010
- Saghazadeh A, Rezaei N. Immune-epidemiological parameters of the novel coronavirus - a perspective [published online ahead of print, 2020 Apr 6]. Expert Rev Clin Immunol. 2020;0(0):1–6. doi:10.1080/1744666X.2020.1750954
- Scannapieco FA (2006). Pneumonia in nonambulatory patients. The role of oral bacteria and oral hygiene. J Am Dent Assoc 137Suppl, 21S–25S.
- Scannapieco FA & Binkley CJ (2012). Modest reduction in risk for ventilator‐associated pneumonia in critically ill patients receiving mechanical ventilation following topical oral chlorhexidine. J Evid Based Dent Pract 12, 15–17.
- Scannapieco FA, Stewart EM & Mylotte JM(1992). Colonization of dental plaque by respiratory pathogens in medical intensive care patients. Crit Care Med 20, 740–745.
- SILVA Nora, ABUSLEME Loreto, BRAVO Denisse, DUTZAN Nicolás, GARCIA-SESNICH Jocelyn, VERNAL Rolando et al . Host response mechanisms in periodontal diseases. J. Appl. Oral Sci. [Internet]. 2015 June [cited 2020 May 03] ; 23( 3 ): 329-355. Available from: http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1678-77572015000300329&lng=en. https://doi.org/10.1590/1678-775720140259.
- Sinclair DG & Evans TW (1994). Nosocomial pneumonia in the intensive care unit. Br J Hosp Med 51, 177–180.
- Shenker BJ, Vitale L, Slots J. Immunosuppressive effects of Prevotella intermedia on in vitro human lymphocyte activation. Infect Immun. 1991;59(12):4583–4589.)
- Shinzato T & Saito A (1995). The Streptococcus milleri group as a cause of pulmonary infections. Clin Infect Dis 21 Suppl 3, S238–S243.
- Terpenning M, Bretz W, Lopatin D, Langmore S, Dominguez B & Loesche W (1993). Bacterial colonization of saliva and plaque in the elderly. Clin Infect Dis 16 Suppl 4, S314–S316.
- Toews GB (1986). Nosocomial pneumonia. Am J Med Sci 291, 355–367.
- Ussar S, Fujisaka S, Kahn CR. Interactions between host genetics and gut microbiome in diabetes and metabolic syndrome. Mol. Metab. 2016;5:795–803.
- Veloso FT. Extraintestinal manifestations of inflammatory bowel disease: do they influence treatment and outcome? World J Gastroenterol. 2011 Jun 14;17(22):2702-7. doi: 10.3748/wjg.v17.i22.2702. Review. PubMed PMID: 21734777;PubMed Central PMCID: PMC3122258.
- Wang B, Li R, Lu Z, Huang Y. Does comorbidity increase the risk of patients with COVID-19: evidence from meta-analysis. Aging (Albany NY). 2020;12(7):6049–6057. doi:10.18632/aging.103000
- Wani, Priyanka et al. “The Forgotten One: Lemierre's Syndrome Due to Gram-Negative Rods Prevotella Bacteremia.” The American journal of case reportsvol. 17 18-22. 11 Jan. 2016, doi:10.12659/ajcr.895560
- Xiao, Fei et al. Evidence for Gastrointestinal Infection of SARS-CoV-2. Gastroenterology. 2020 Mar 3. pii: S0016-5085(20)30282-1. doi: 10.1053/j.gastro.2020.02.055. [Epub ahead of print]
- Yoneyama T, Hashimoto K, Fukuda H, Ishida M, Arai H, Sekizawa K, Yamaya M & Sasaki H(1996). Oral hygiene reduces respiratory infections in elderly bed‐bound nursing home patients. Arch Gerontol Geriatr 22, 11–19.
- Yousef A. AlJehani. Risk Factors of Periodontal disease: review of literature. Special Isue: Epidemiology and Diagnosis of Periodontal Diseases: Recent Advances and Emerging Trends. Volume 2014, Article ID 182513, 9 pages, https://doi.org/10.1155/2014/182513
- Yuan A, Yang PC, Lee LN, Chang DB, Kuo SH & Luh KT (1992). Actinobacillus actinomycetemcomitans pneumonia with chest wall involvement and rib destruction. Chest101, 1450–1452.
- Zijlstra EE, Swart GR, Godfroy FJ & Degener JE(1992). Pericarditis, pneumonia and brain abscess due to a combined Actinomyces–Actinobacillus actinomycetemcomitansinfection. J Infect 25, 83–87.
- Zhang, B., et al., Clinical characteristics of 82 death cases with COVID-19. medRxiv, 2020: p. 2020.02.26.20028191.
- Zhang X, Zhang D, Jia H, Feng Q, Wang D, Liang D, Wu X, Li J, Tang L, Li Y, et al. The oral and gut microbiomes are perturbed in rheumatoid arthritis and partly normalized after treatment. Nat Med. 2015;21(8):895–905
- Zheng KI, Gao F, Wang XB, et al. Obesity as a risk factor for greater severity of COVID-19 in patients with metabolic associated fatty liver disease [published online ahead of print, 2020 Apr 19]. Metabolism. 2020;154244. doi:10.1016/j.metabol.2020.154244
- Zhu, Weifei et al., Gut Microbial Metabolite TMAO Enhances Platelet Hyperreactivity and Thrombosis Risk, Cell, Volume 165, Issue 1, 111 - 124