Technique de préservation alvéolaire laser PAL
 Comment peut-on préserver l'alvéole en cas d'extraction dentaire?. Traitement par laser
Comment peut-on préserver l'alvéole en cas d'extraction dentaire?. Traitement par laser
Mots clés : alvéole, extraction, caillot, absorption laser, effets photo-thermiques
Auteur : Docteur Thierry Maleca
Exercice exclusif lasers/Parodontologie/Implantologie
Préface
L’extraction dentaire est malheureusement l’acte le plus réalisé dans le monde au quotidien.
En omnipratique comme en pré-implantologie, la préservation maximale des tissus alvéolaires, comprenant os et tissus mous sont essentiels et garants d’une esthétique mieux gérée.
Certains lasers, à travers leurs propriétés sur le tissu sanguin, nous permettent de décontaminer, de stabiliser le caillot par effet photo- thermique et de stimuler les réponses tissulaires par effet de low level laser irradiation (LLLI) afin d’optimiser de manière maximale la réparation post extractionnelle.
Je pratique cette technique depuis 2010 sur l’ensemble des extractions réalisées au cabinet.
Les résultats cliniques sont intéressants en terme de fermeture rapide des sites d’extraction, selon le protocole de Préservation Alvéolaire Laser : PAL.
Outre la finesse de la table osseuse vestibulaire des maxillaires (1) et la difficulté à la recréer par comblement, les études montrent que même après la reconstruction alvéolaire , la cicatrisation des alvéoles est retardée (2), (3) .
C’est à ce moment que la technique de PAL est intéressante cliniquement, sur un processus qui naturellement est long, (4), en attendant d’observer les résultats scientifiques.
Introduction
Les techniques chirurgicales évoluent rapidement et brillent de leurs simplifications thérapeutiques par une rationalisation des outils utilisés et par une réduction de la durée des plans de traitement et des temps opératoires.
Les patients sont les premiers gagnants de ces évolutions car ils sont sujets à des suites opératoires fortement réduites.
Dans différents domaines, les lasers ont prouvé d’excellentes propriétés biologiques sur les tissus telles qu’en médecine spécialisée, dermatologie, gynécologie, oncologie , chirurgie vasculaire , entre autre.
Certaines longueurs d’ondes sont extrêmement intéressantes en termes de coagulation et de stabilisation des caillots.
En effet, certains lasers pénétrants, de part de leurs effets photo-thermiques nous permettent de travailler sur le sang pour initier une coagulation avancée et le solidifier pour offrir une surface propice à une prolifération rapide de cellules épithéliales.
Les premiers lasers utilisés en chirurgie vasculaire ont été les lasers Néodinium Yag (Nd :Yag), dès 1973 ; ce sont des outils de choix pour leur absorption dans le sang .
Les lasers diodes permettent également de travailler efficacement sur l’hémoglobine. (cf courbes d’absorption, fig 1)
Ce qui est intéressant dans l’utilisation de longueurs d’ondes pénétrantes (entre 600 et 1200nm) est leurs propriétés bio-stimulantes à distance dans les tissus, à environ 10mm
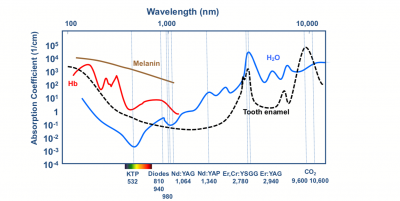
Fig 1 : courbes d’absorption dans les éléments en présence, dans le tissu gingival
Journal of laser dentistery ; 2008 (4’)
Physiologie
Si l’on observe la chronologie de la cicatrisation alvéolaire post extractionnelle, la résorption osseuse peut atteindre 40 à 60% sur plusieurs années (4), même si la perte osseuse la plus importante se fait sur une année (5).
Plus précocement à J+1, on observe la formation d’un caillot, puis ce dernier commence à se remanier à 3 jours, par nécrose centrifuge et s’ensuit l’apparition d’un tissu de granulation richement vascularisé.
Il faut attendre 14 jours avant de trouver un tissu conjonctif et un tissu mésenchymateux qui se lie aux cellules épithéliales, provoquant une fermeture de l’alvéole.
La maturation osseuse est signée par la présence de cellules adipeuses à 6 mois
Cette fermeture est également conditionnée par la vascularisation de l’alvéole qui dépend des conditions locales : présence de vasoconstricteurs, type d’anesthésie et qualité vasculaire du maxillaire avec tous les ralentissements dus à un tabagisme existant , prise de médications modifiant la vascularisation osseuse , gingivale ou altérant le métabolisme osseux.
Toutes les techniques récentes de régénération osseuse visent à fermer au plus tôt l’alvéole dans le but de la combler afin de proposer des conditions favorables
pré- implantaires et ainsi d’offrir aux cellules épithéliales un support stable pour une épithélialisation rapide, selon la clinique observée.
Le premier effet intéressant des lasers absorbés dans le sang est de permettre de vasodilater les vaisseaux et de remplir plus rapidement l’alvéole dentaire.
En augmentant l’effet thermique, la vasodilatation va se poursuivre tout en coagulant le sang sur l’ensemble de l’alvéole pour créer un « bouchon » sanguin semi-solide.
L’effet photo-thermique augmente progressivement dans la partie coronaire de l’alvéole.
La dernière étape consiste à offrir aux cellules épithéliales un support stable pour permettre leur prolifération rapide.
Pour cela, une « calcination » superficielle est réalisée à l’aide du laser diode dans un premier temps, en augmentant la puissance et la fréquence jusqu’à aboutir à une irradiation continue.
Un laser erbium, par effet d’absorption superficielle, viendra confirmer l’étanchéité en « soudant » le caillot avec les berges épithéliales.
Un bouchon sanguin, greffon autogène sanguin est ainsi créé.
Que se passe t-il lorsque l’on travaille dans une alvéole avec un laser absorbé dans le sang ?
Voici les mécanismes observés en médecine vasculaire.
La composition en hémoglobine est la suivante : hémoglobine, (Hb), oxy hémoglobine, (oxy Hb) et méthémoglobine, (Met Hb) lorsque le sang s’oxygène il s’enrichit en oxy hémoglobine (6).
Le premier effet du chauffage sanguin lors d’une irradiation laser est de changer sa structure physico chimique et ses propriétés optiques, on observe alors la formation d’oxy Hb et de met hémoglobine , il est important de savoir que même après chauffage, la structure sanguine continue à changer.
Lorsqu’on irradie le sang, on favorise la formation de met hémoglobine.
Il est intéressant de noter que cette méthémoglobine absorbe de 5 à 20 fois plus l’irradiation laser, l’efficacité est ainsi accrue, le tissu cible étant beaucoup plus réceptif à ce rayonnement laser , cela réduit significativement les effets secondaires d’augmentation thermique des tissus environnants.
En dehors des effets thermiques, toute irradiation d’une longueur d’onde pénétrante dans les tissus gingivaux produira en profondeur une stimulation des réactions tissulaires, appelée LLLI. Parmi les différents effets décrits dans la littérature (19) , la production d’ATP intra cellulaire, mitose, scission du médiateur NO et ses effets vasculaires extra cellulaires, amélioration de la néo angiogenèse et des débits vasculaires et lymphatiques entre autres
La conséquence est la possibilité de traiter des patients dont le potentiel de cicatrisation est réduit : prise de biphosphonates ou de traitements anti cancéreux (cas clinique 2)
Protocole
La préservation alvéolaire laser assistée va agir sur la vascularisation du site d’extraction afin d’obtenir un remplissage sanguin conséquent et de stabiliser le caillot sur toute sa hauteur permettant d’obtenir un support stable et favorable à une fermeture rapide de l’alvéole.
Pour obtenir le maximum d’efficacité sur le tissu sanguin, les lasers absorbés dans l’hémoglobine sont de choix ; on peut citer les lasers diodes (de 400 à 1000nm) et le Nd :Yag (1064nm) qui est le laser vasculaire utilisé en médecine depuis les années 70 (7),(8).
Le principe est de créer et d’utiliser un caillot ayant rempli la totalité de l’alvéole.
Puis un travail thermique va commencer sur les 2/3 de la hauteur du site : mode discontinu et fréquence faible, ce n’est que lorsque le sang commence à s’agglutiner sur la fibre, qu’il conviendra de commencer à façonner superficiellement, de manière à créer une surface propice à la colonisation des cellules épithéliales.
Une soudure avec les berges épithéliales est alors réalisée pour terminer le traitement à la séance.
Le temps moyen d’intervention, hors temps d’extraction, pour un traitement stabilisé d’alvéole ne dépasse pas , dans les cas les plus complexes, les 10 minutes.
Les suites opératoires sont réduites voire quasi inexistantes et le protocole est applicable à toutes les extractions.
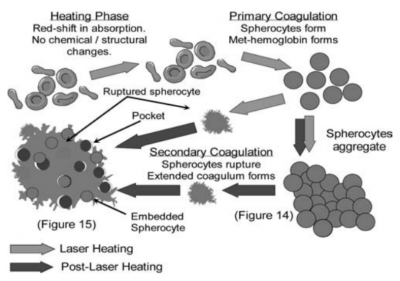
Fig2 : mécanisme biochimique de coagulation par absorption de l’énergie laser (16)
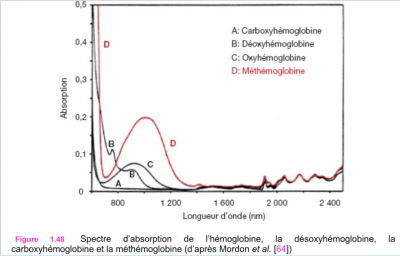
Fig3 : Intérêt de la présence de méthémoglobine dans le sang de l’alvéole irradiée.
Protocole clinique et cas clinique :
Une patiente de 69 ans présente une mobilité terminale de 12 avec gène fonctionnelle à l’élocution et mastication.
Perte osseuse importante et inflammation parodontale avec défaut vestibulaire important.
Patiente sous Orocal depuis 2010 avec ostéoporose
L’avulsion est décidée avec PAL et remplacement par rajout d’une dent sur prothèse adjointe mobile (1A).
Après extraction, l’objectif est de pouvoir débarrasser l’alvéole des tissus mous infectés (kystes, tissus de granulation et débris) amenant l’utilisation d’un laser Er :Yag qui simplifiera la procédure.
La fréquence utilisée sera de 30 Hz avec une énergie de 230 mJ pour un temps d’impulse de 300 micro secondes.
Ces paramètres vont varier en fonction de l’objectif à atteindre : tissu kystique important et hémorragique, on cherchera à augmenter l’hémostase.
Si un tissu osseux est à préparer, l’impulse sera très court pour un pic d’énergie plus important.
Le deuxième temps, il consistera à obtenir un caillot suffisant en volume dans l’alvéole : pour cela nous utiliserons le laser diode sur un mode discontinu, avec une fréquence de 10kHz sur l’ensemble de l’alvéole, ti on 50micro secondes et ti off 50 micro secondes, puissance 2 W.
Dés que l’alvéole est pleine, on se dirige vers une irradiation plus puissante qui auto-active la fibre et augmente l’effet thermique
Le dernier temps opératoire est une calcination de surface pour permettre une prolifération rapide de l’épithélium provoquant la fermeture du site.
Erbium :Yag , 50mJ sans air et sans eau , en passage sur les lèvres épithéliales qui bordent l’alvéole.
Cas clinique 1
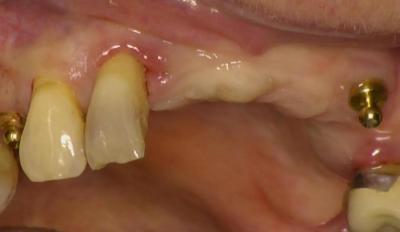
Fig.1A : état initial de 12
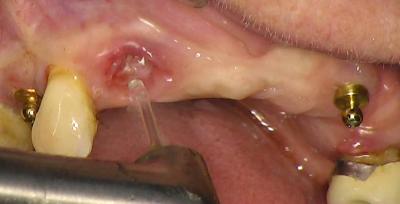
Fig.2A : Er Yag pour préparation du tissu gingival
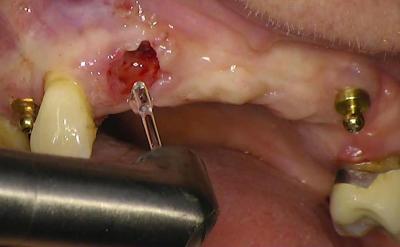
Fig.2B : Er Yag pour préparation osseuse
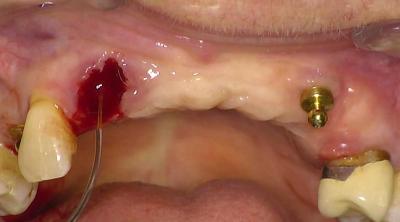
Fig.3 : effet vasodilatateur du diode 980nm
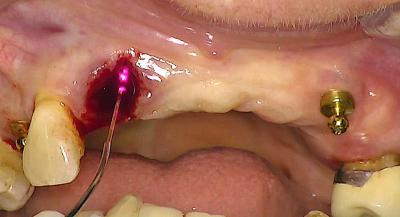
Fig.4 : début d’effet de coagulation
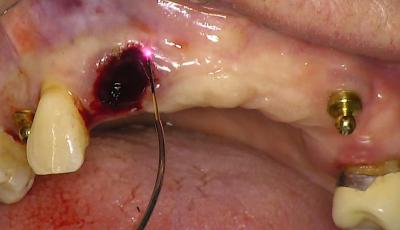
Fig.5 : coagulation de la surface et « soudure » avec les berges épithéliales
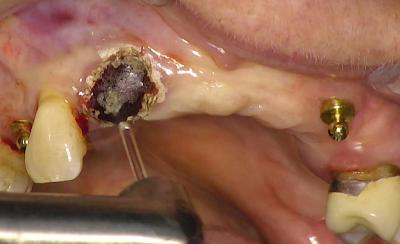
Fig.6 : Dessiccation superficielle à l’Er Yag
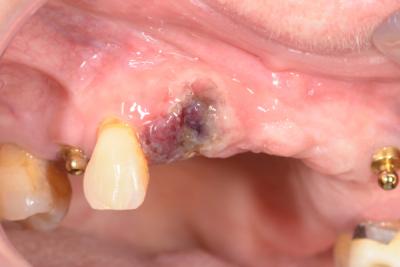
Résultat à 24 heures
Cas clinique 2
Patiente de 52 ans, traitée par chimiothérapie d’un cancer du sein, qui s’est faite extraire la 47 en février 2016 et qui présente une ostéonécrose suite cette avulsion
La patiente est sous denosumab (xgeva) depuis 2013, suspendu depuis 2015 , avec chimio relais jusqu’en mars 2016
Séances de LLLT (635nm) et de travail mécanique sur les parois osseuses avec erbium Yag , une fois par semaine d’avril à juillet 2016
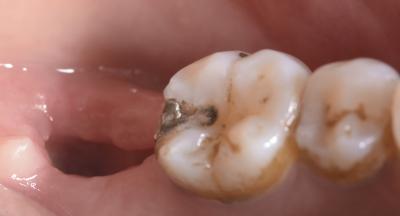
Travail de LLLT sur un site au métabolisme osseux réduit et mal vascularisé
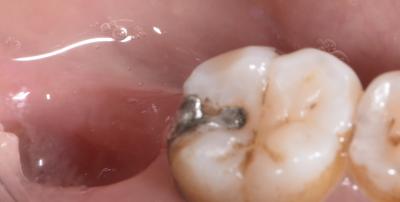
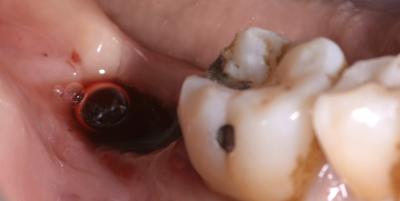

Au fil des séances le saignement est de plus en plus marqué et devient suffisant a une cicatrisation alvéolaire
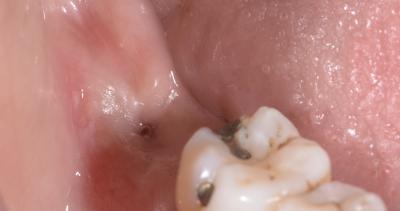
Fermeture quasi complète après revascularisation du site
Conclusion
Les extractions sont les actes dentaires les plus communs et réalisés dans le monde, la préservation alvéolaire laser assistée permet de créer, de façon simple, un caillot stable qui réduit les suites douloureuses post opératoires et qui permet également une fermeture rapide du site alvéolaire.
Ce protocole est également intéressant en pré-implantaire car la difficulté est de combler un site d’extraction et d’en obtenir une fermeture rapide et non retardée.
J’utilise cette technique révolutionnaire de traitement post extractionnel auprès de mes patients depuis de nombreuses années pour les raisons de confort et de sécurité que vous connaissez maintenant , des études scientifiques doivent malgré tout venir confirmer leur intérêt biologique. Outre son avantage clinique .
Références bibliographiques
[1] Maleca T. Préservation alvéolaire post extractionnelle Intérêt de l’utilisation des lasers diode ; Clinic 2014
[2] Braut V, Belser U, Buser D. Thickness of the anterior maxillary facial bone wall.A retrospective radiographic study using cone beam computed tomography. Int J Periodontics Restorative Dent 2011;31:125-131.
[3] Hong JY, Lee JS, Pang EK, Jung UW, Choi SH, Kim CK. Impact of different synthetic bone fillers on healing of extraction sockets : an experimental study in dogs. Clin Oral Implants Res 2014;25:e30-e37.
[4] Guo X, HU H, Liu Y, Bao C, Wang L, The effect of hemostatic agents on early healing of extraction socket. J Clin Periodontol. 2019 Apr 30
[5] Cardaropoli G, Araújo M, Lindhe J. Dynamics of bone tissue formation in tooth extraction sites. J Clin Periodontol 2003;30:809-818.
[6] Araújo MG, Lindhe J. Dimensional ridge alterations following tooth extraction. An experimental study in the dog. J Clin Periodon- tol 2005:32:212-218.
(7] Coluzzi DJ. Fundamentals of lasers in dentistery: basic science, tissue interaction, and instrumentation. J Laser Dent
(8) Kevan Noury, Lasers in dermatology and medicine, 2011, p 334
2008: 16: 4–10.
(8] Schropp L, Wenzel A, Kosto- poulos L, Karring T. Bone healing and soft tissue contour changes following single-tooth extraction : a clinical and radiographic 12- month prospective study. Int J Periodontics Restorative Dent 2003:23:313-323.
[9] Jacek Matys , Katarzyna Uwider, Kinga Grzech-LeVniak , Marzena Dominiak, and Umberto Romeo Photobiomodulation by a 635nm Diode Laser on Peri-Implant Bone: Primary and Secondary Stability and Bone Density Analysis—A Randomized Clinical Trial, BioMed Research International Volume 2019, Article ID 2785302, 8 pages
[10] Nevins M, Camelo M, De Paoli S, Friedland B, Schenk RK, Parma- Benfenati S et al. A study of the fate of the buccal wall of extraction sockets of teeth with prominent roots. Int J Periodontics Res- torative Dent 2006:26:19-29.
[11] Rey G, Missika P. Traitements parodontaux et lasers en omni pratique dentaire. Issy-les-Moulineaux : Elsevier Masson, 2010.
[12] Rey G, Missika P. Les lasers et la chirurgie dentaire. Rueil-Malmaison : CdP, 2010.
[13] Schneider D, Hinze M, Wachtel H. Dimensional alterations of extraction sites after different alveolar ridge preservation techniques – a volumetric study. J Clin Periodontol 2013;40:721-727.
[14] Lindhe J, Cecchinato D, Donati M, Tomasi C, Liljenberg B. Ridge preservation with the use of deproteinized bovine bone mineral. Clin Oral Implants Res 2013 (accepté pour publication).
[15] Araujo MG, Liljenberg B, Lindhe J. Dynamics of Bio-Oss collagen incorporation in fresh extraction wounds : an experi- mental study inthe dog. Clin Oral Implants Res 2010:21:55-64.
[16] Gutknecht N. Der Diodenla- serund seine bakterizideWirkun- gimWurzelkanal. Eine in vitro stu- die. Endodontie 1997;3:217-222.
[17] Maleca T. Intérêt de l’utilisation des lasers erbium en chirurgie muco-gingivale. Lasers et stomatologie 2013;57:15.
[18] Moritz A, Shoop U, Shauer P. Treatment of periodontal pockets with a diode laser. Lasers Surg Med 1998:22:302-311.