Régénération osseuse assistée par laser
par le Dr Gérard Rey
I. NOTIONS DE BIOLOGIE OSSEUSE
A. LE TISSU OSSEUX
Ce tissu minéralisé qui constitue l’ensemble du squelette contient peu d’eau (22,5 %) mais il constitue un réservoir essentiel en calcium de notre organisme avec 98 % de l’ensemble de cet important constituant cellulaire.
On distingue deux types de tissus osseux matures : le tissu osseux compact et le tissu osseux spongieux, constitués par des cellules enchâssées dans une matrice plus ou moins minéralisée.
Dans le tissu osseux compact, on discerne des lamelles circulaires nommées Ostéons et centrées autour du canal de Havers. Ce canal permet la circulation des capillaires sanguins et des fibres nerveuses. Le tissu osseux spongieux contient, lui, de multiples cavités qui renferment des vaisseaux et de la moelle osseuse.
Lire aussi sur le sujet :
L'efficacité prouvée des traitements parodiontaux assistés aux laser diode
La maintenance parodontale : acte essentiel aprés traitement des parodontites et peri implantites
Simplicité et efficacité en hyguène bucco-dentaire
Place des lasers en Esthétique bucco dentaire quotidienne
Influence de l’utilisation d’un laser diode dans l’extraction des dents de sagesse incluses
1. La matrice et les cellules osseuses
Le tissu osseux comprend :
- 35 % de matrice organique formée à 90 % de collagène 1 et d’autres protéines telles que l’ostéocalcine qui est synthétisée par les ostéoblastes en présence de Vitamine K.
- 60 % de matrice minérale riche en calcium et en phosphore. Cette phase minérale est constituée de cristaux d’hydroxyapatite (phosphate de calcium cristallisé + Carbonate de calcium) enchâssés entre des fibres de collagène.
- 5 % de cellules osseuses constituées principalement par les ostéoblastes, les ostéocytes et les ostéoclastes.
Origine des cellules osseuses :
Les cellules mésenchymateuses bien oxygénées se transforment en cellules ostéogéniques qui se multiplient et deviennent des ostéoblastes.
Ces cellules sont les seules de notre organisme capables de synthétiser de la matrice osseuse calcifiée.
Certains ostéoblastes s’enferment dans la trame osseuse et deviennent des ostéocytes responsables de l’entretien de la matrice extra cellulaire osseuse. (MEC osseuse)
Les ostéoclastes sont des macrophages spécialisés dans la résorption des tissus osseux. Ce sont des cellules plurinucléées géantes (de 20 à 100 microns de diamètre).
L’activité ostéoclastique est permanente et nécessaire au renouvellement de notre squelette. Cette résorption du tissu osseux agit en synergie avec l’activité ostéoblastique reconstructrice. (Monnet-Corti V et al 2006).
2. Le remodelage osseux
Sur l’os naturel, un cycle de remodelage osseux dure entre 4 et 6 mois avec cinq phases principales décrites au paragraphe IC de cet article.
Phase d’activation
Phase de résorption
Phase d’inversion
Phase de régénération
Phase de repos
Le remodelage osseux joue un rôle essentiel dans la survie des greffes destinées à redonner une anatomie convenable aux maxillaires des malades.
B. OS AUTOGENES OU BIOMATERIAUX ?
1. Avantages et Inconvénients
Il semble préférable de considérer chaque cas différemment en fonction de la disponibilité des sites de prélèvement. Les patients présentant un os autogène abondant et facile d’accès sont très volontiers dirigés vers des prélèvements autogènes mais la disponibilité en volume des biomatériaux incite à choisir cette technique pour les reconstructions importantes. (Giannoudous P et al 2005)
Les prélèvements pariétaux ou mandibulaires (fig. 1) permettent parfois d’obtenir des volumes osseux importants mais la régénération des sites de prélèvement est très aléatoire voire parfois inexistante.
Fig. 1 - Les prélèvement autogènes nécessitent souvent un deuxième site opératoire
Consulter l'article avec les photos
Les biomatériaux n’avaient pas notre faveur avant les années 2000 étant donné leur seule propriété ostéo conductrice et leur faible résorption mais les résultats obtenus aujourd’hui sont très différents avec l’utilisation des lasers et l’incorporation des facteurs de croissance (fig. 2).
Fig. 2 – Remodelage d’une crête osseuse complète avec Bio-oss granules fins
Les techniques actuelles de l’utilisation des biomatériaux qui sont décrites plus loin dans les 12 étapes du protocole proposé permettent d’aborder facilement la chirurgie reconstructrice de tous les sites osseux maxillaires, mandibulaires ou intra sinusiens, quelque soit leur importance et avec la possibilité d’un modelage anatomique initial tout à fait favorable à l’adaptation des futures prothèses.
Le cas des figures 3 et 4 montre une greffe vestibulo palatine au niveau des dents 24 et 25 avec mise en place conjointe d’un implant, et le cas d’une greffe intra sinusienne complétée par une greffe crestale s’étendant sur les parties vestibulaires et palatines (Veda M et al 2005).
Ces techniques d’englobement de l’os résiduel sont très délicates, et parfois impossibles à réaliser avec les seuls prélèvements autogènes.
Fig. 3 – Plan de traitement prévisionnel avec
Fig. 4 – Radiographie de contrôle à 6 mois remodelage vestibulo-crestal-palatin postopératoires
Les résultats obtenus radiographiquement à 6 mois (Fig. 4) et cliniquement à 9 mois (Fig. 5) montrent un os reconstitué de bon volume et de bonne qualité avec un torque initial à la mise en place des implants supérieur à 30 newtons.
Fig. 5 – Etat clinique à 9 mois postopératoires – Présence d’un os mature bien vascularisé
Il appartient donc à chacun de choisir son propre « Gold standard » en fonction de chaque cas clinique.
2. La réalité sur la survie des prélèvements autogènes
L’ostéogénèse et la survie directe d’un greffon autogène nécessitent des conditions particulières et une excellente revascularisation de l’ensemble du greffon.
Il s’avère que ceci est extrêmement aléatoire particulièrement dans les reconstructions maxillaires et mandibulaires pour lesquelles l’isolation complète des sites greffés sous pansement stérile n’est pas envisageable.
Les prélèvements autogènes permettent également d’obtenir des greffons aux propriétés ostéo inductrices à partir des CSM du site receveur. Nous savons aujourd’hui que cette ostéo induction est très limitée et que la très grande majorité du greffon autogène va subir une résorption pour être remplacé par un os néoformé dans la limite de la prolifération vasculaire nécessaire à cette ostéogénèse. Nous assistons fréquemment à une disparition par ostéo nécrose de la partie superficielle du greffon autogène lorsque la revascularisation de ce greffon n’est pas suffisante en superficie.
Dans la grande majorité des cas de reconstruction osseuse, nous sommes en présence d’une ostéo conduction à partir du greffon qu’il soit autogène, allogène ou xénogène.
L’ostéo conduction est donc la principale source de néo formation osseuse (Anagnostou F et al 2000).
3. Le respect du choix du patient
L’information aux patients doit être complète et précise pour lui laisser le choix de reconstruire les volumes osseux déficients soit par prélèvement autogène et ostéosynthèse (fig. 6) ou par mélange de biomatériaux et facteurs de croissance (fig. 7) dont nous verrons l’élaboration dans ce même article.
Fig. 6 Greffons autogènes après prélèvement pariétal de croissance
Fig. 7 Préparation d’un biomatériau poreux mélangé aux facteurs
Après avoir testé de nombreux substituts osseux (allogreffes, xénogreffes, matériaux synthétiques, …), notre choix personnel se porte aujourd’hui sur l’abandon des blocs au profit de granules fins (Bio-oss 0,25), ce biomatériau ayant une anatomie très comparable à celle de l’os naturel (Rickert D et al 2011).
C. FACTEURS FAVORISANTS LA RÉPARATION OSSEUSE
1. Rôle des cellules dans les phases de remodelage osseux (Fig. 8)
Fig. 8 - Schéma des phases de remodelage osseux
Les cellules des tissus osseux participent à la réparation osseuse suivant un cycle permanent divisé en 5 phases principales :
a) Une phase d’activation
Les cellules bordantes (issues des ostéoblastes) qui protègent la surface osseuse vont se rétracter sous l’action de différents facteurs ostéo résorbants dont « l’hormone parathyroïdienne ».
Certaines molécules synthétisées par les ostéoblastes (macrophage colony stimulating factor) vont favoriser la prolifération des ostéoclastes qui pourront accéder à la surface osseuse désormais libérée de la protection des cellules bordantes.
b) Une phase de résorption
Les ostéoclastes se fixent à la surface osseuse par des prolongements (podosomes) délimitant une chambre de digestion. L’acidification de la chambre de digestion et l’action des enzymes protéolytiques provenant des lysosomes permettent la dissolution des phases minérales et organiques des tissus osseux.
Cette activité cellulaire est appelée « Ostéoclasie ». Elle provoque des zones lacunaires dénommées « Lacunes de Howship ».
c) Une phase d’inversion
A la fin de leur travail de résorption, les ostéoclastes meurent par apoptose. Les macrophages arrivent en grand nombre dans les lacunes pour les nettoyer et en lisser les parois.
d) Une phase de régénération
Elle dépend uniquement des ostéoblastes qui sont à l’origine de la matrice organique initiale puis de la minéralisation de cette matrice.
La vascularisation joue un rôle essentiel en amenant sur le site des facteurs sanguins favorables à l’ostéogénèse :
les oestrogènes qui stimulent l’activité des ostéoblastes
la calcitonine qui inhibent l’activité des ostéoclastes
e) Une phase de repos
Pendant cette phase de repos, la majorité des ostéoblastes se sont différenciés soit en cellules bordantes (ostéoblastes au repos), soit en ostéocytes (ostéoblastes entourés d’une matrice osseuse).
Les ostéocytes sont reliés entre eux et avec les ostéoblastes par des prolongements cytoplasmiques pour gérer la matrice extracellulaire osseuse.
Ils transmettraient les forces de tension mécanique exercées sur l’os pour réguler l’activité des ostéoblastes.
2. Rôle des protéines
Le tissu osseux contient de nombreux facteurs de croissance et de différenciation qui contrôlent la résorption et la régénération osseuse.
Le rôle des protéines commence dès la résorption pendant laquelle l’os produit des protéines solubles (BMP et facteurs de croissance) qui stimulent l’ostéogénèse.
Les BMP (Bone Morphogenic Protein)
Ces protéines de la morphogénèse osseuse possèdent des propriétés ostéo-inductrices démontrées (Urist ML et al 1965 et 1973) qui permettent d’envisager des applications thérapeutiques en chirurgie osseuse.
La large gamme de biomatériaux dont nous disposons aujourd’hui permet de choisir la matrice d’incorporation la mieux adaptée à notre intervention. L’os bovin représentant la source la plus couramment utilisée pour l’étude et l’activité des BMP.
Les BMP 2 et BMP 4 font partie de la famille des TGF β et sont également synthétisées dans l’épithélium des germes dentaires et dans les odontoblastes de la papille (Vainios et al 1993).
Ces protéines ont un rôle important sur l’activité des cellules ostéoblastiques (Jayakumar A et al 2011) :
- BMP 2 augmente la synthèse de la phosphatase alcaline qui favorise la différenciation des cellules médullaires en adipocytes ou en ostéoblastes (Thies RS 1990)
- BMP 4 stimule l’activité ostéoblastique par la prolifération et la différenciation des cellules ostéogéniques.
Les recherches chez le rat ont démontré une augmentation significative de la formation osseuse et une réunion parfaite entre l’os néoformé et le tissu osseux initial (Toriumi DM et al 1991).
Dans notre spécialité clinique, l’utilisation des BMP nécessite un vecteur qui doit répondre à quatre obligations précises :
être bio compatible
être biodégradable
permettre l’incorporation de la protéine sans la dégrader
permettre la libération lente des principes actifs.
3. Le rôle de la Fibrine Riche en Plaquettes (PRF)
La centrifugation effectuée (environ 2900 à 3000 tours/minute pendant 11 à 12 minutes) va permettre de séparer les hématies et de récupérer les plaquettes sanguines et les leucocytes, cellules riches en facteurs de croissance (Hynes K et al 2000).
a) Les plaquettes sanguines (ou thrombocytes)
Ce sont des cellules qui proviennent de la fragmentation des mégacaryocytes de la moelle osseuse. Elles contiennent, entre autre, une protéine adhésive (fibronectine) et des facteurs de croissance comme PDGF (Plateled Derived Growth Factor) qui possède un rôle important dans la régulation de la division cellulaire.
C’est un agent mitogène pour les cellules d’origine mésenchymateuse qui est utilisé dans le traitement des pertes osseuses en orthopédie (Mole C 2006).
Le nombre de plaquettes obtenues par centrifugation est très important avec plus de 300.000 plaquettes par millimètre cube, soit environ 2 milliards dans une membrane PRF !
b) Les Leucocytes
Leur concentration dans le PRF est d’environ 8000 cellules par millimètre cube et permet d’en obtenir plus de 8 millions dans une membrane PRF.
Ils libèrent sur le site de nombreuses cytokines favorables à la cicatrisation des plaies osseuses dont TGF β-1 (Transforming Growth Factor β-1) qui favorisent la prolifération et la différenciation cellulaire et VEGF (Vascular Endothelial Growth Factor) qui joue un rôle dans l’angiogenèse et le développement sur le site greffé de nouveaux vaisseaux sanguins.
c) La Fibrine
Le dernier élément récupéré lors de la centrifugation est la principale matrice de cicatrisation dont la polymérisation lente permet une conjonction des monomères de fibrine et la création d’un réseau à mailles fines protecteur.
Ce réseau, perméable à la migration cellulaire, reste donc favorable à la revascularisation du site, deux éléments nécessaires à la cicatrisation rapide des plaies osseuses.
Les caillots de fibrine riche en plaquettes (PRF) sont utilisés de trois manières complémentaires :
finement découpés et mélangés au biomatériau (Bio-oss granules fins)
en membranes protectrices après compression des caillots
en imprégnant les membranes collagènes (Biogide) et le biomatériau avec l’exsudat résultant de la compression des caillots. Cet exsudat est riche en fibronectines (protéines d’adhésion).
Ainsi utilisés, les prélèvements sanguins centrifugés permettent d’apporter des facteurs favorables à la régénération osseuse pendant une semaine environ (fig. 9) (Choukroun J et al 2001)
Fig. 9 – Représentation schématique d’un caillot de PRF
D. LES DIFFERENTES PHASES CICATRICIELLES DES PLAIES OSSEUSES
La cicatrisation d’une plaie osseuse (une extraction dentaire, par exemple) se passe suivant quatre phases successives qui permettent la régénération des tissus osseux et gingivaux.
Les greffes osseuses et les régénérations par biomatériaux subissent en général le même processus dont le succès et la rapidité de transformation en os naturel mature dépend beaucoup de la vascularisation disponible par l’intermédiaire des parois osseuses et gingivales encadrant le site greffé (Fig. 10) (Precker HV 2007).
Fig. 10 – Plaie osseuse après extraction dentaire
1) La phase de l’Hématome
Cette une phase inflammatoire dure deux à trois jours avec un saignement initial général de la plaie à l’origine de l’hématome (fig.11)
La coagulation et le caillot sanguin consécutif attirent les macrophages dans le fond de la plaie. L’agrégat plaquettaire obtenu va libérer des facteurs de croissance (PDGF, TGF β-1, VEGF, IGF 1) et l’exsudat plasmatique consécutif est riche en leucocytes, histiocytes et mastocytes.
Les cytokines libérées par ces différentes cellules sont impliquées dans la réaction inflammatoire de cette phase initiale aigue avec notamment :
Interleukine IL-1 (secrétée par les macrophages)
Tumor Nécrosis Factor (TNF α) libérée par les leucocytes
IL-4 qui favorise la différenciation des lymphocytes
Fig.11 – Schéma de la phase de l’hématome
2) La phase d’hypovascularisation
Elle peut durer entre une et trois semaines postopératoires et est plus ou moins importante suivant l’importance de la plaie osseuse et la possibilité ou non d’obtenir une fermeture des berges gingivales sans tension excessive.
Les tissus superficiels sont hypovascularisés (fig.12) avec un tissu blanchâtre d’aspect nécrotique.
En réalité, cette fibrine superficielle protège les réactions tissulaires internes sous la partie visible avec présence d’un tissu de granulation en cours de résorption par l’action des macrophages qui accompagnent la progression des bourgeons vasculaires issus des parois osseuses périphériques.
La pénétration vasculaire peut être de 0,3 millimètre par jour dans des conditions favorables.
Dans la profondeur de la plaie osseuse (ou du greffon mis en place), la néo vascularisation permet déjà l’arrivée des CSM et des cellules ostéoblastiques avec un début de cicatrisation grâce au dépôt d’un tissu ostéoide non minéralisé qui suit l’action nettoyante des macrophages.
Fig. 12 – Schéma de la phase d’hypovascularisation
3) Phase de revascularisation
Cette phase d’oxygénation et de revascularisation de l’ensemble de la plaie succède à la précédente phase d’hypovascularisation superficielle et permet une cicatrisation de l’épithélium qui protège le tissu ostéoïde superficiel dans lequel les bourgeons vasculaires permettent l’arrivée des cellules ostéogéniques.
Dans la profondeur de la plaie osseuse (ou du greffon), le tissu ostéoïde est remplacé par un os fibrillaire peu minéralisé (fig.13).
Fig. 13 – Schéma de la phase de revascularisation
4) Phase de minéralisation
C’est une phase appelée substitution rampante qui remplace progressivement le tissu osseux primaire par un os mature bien minéralisé. Cette phase dure environ 5 à 6 mois et permet le bon fonctionnement physiologique des ostéons autour des canaux de Havers et la mise en place des ostéocytes permettant une surveillance de la matrice extracellulaire (M.E.C.).
Ce n’est qu’à la fin de la substitution rampante que la vascularisation des tissus osseux néoformés redevient normale. (Colombier ML et al 2005)
C’est pour cette raison que nous évitons toute chirurgie implantaire avant environ 8 mois, délai logique pour un greffon de moyen importance.
E. L’APPORT DES LASERS DANS LES PHASES DE CICATRISATION OSSEUSE
Nous verrons plus loin le choix exact des longueurs d’onde et les réglages appropriés à chaque cas en nous contentant ici d’un rappel général sur les effets utiles possibles dans les phases cicatricielles décrites au paragraphe D. (fig.14) (Caccianiga et al 2005)
Fig.14 – Les effets lasers sont utiles dans toutes les phases de cicatrisation osseuse
1) Les effets thermiques
Consécutivement à une extraction ou à une plaie osseuse provoquée (prélèvement autogène, par exemple), deux incidents peuvent perturber la stabilisation du caillot sanguin souhaité :
soit une absence de saignement (Fig. 10a)
soit un excès de saignement (Fig. 14a)
Dans les deux cas, on peut utiliser les réglages thermiques d’un laser diode pour obtenir une vasodilatation ou une coagulation suivant l’effet thermique recherché.
2) Les effets décontaminants
Une extraction est souvent la conséquence d’un accident infectieux d’origine endodontique ou parodontale.
Cette infection, souvent propagée dans les volumes osseux périphériques, peut facilement être jugulée par l’effet de photothérapie dynamique des rayonnements lasers pénétrants (fig. 14b).
L’effet décontaminant obtenu en présence de tissus oxygénés (Rey 2000 et 2001) est une sécurité très utile avant toute chirurgie post-extractionnelle immédiate et particulièrement avant la mise en place d’un greffon réparateur (Rey G, Missika P. 2010).
3) Les effets photobiostimulants
L’irradiation par un rayonnement laser pénétrant est rendu peu thermique par l’adjonction d’une lentille défocalisante (fig.14c).
Cette thérapie par rayonnement de basse énergie thermique permet :
une prolifération cellulaire avec augmentation des macrophages, des lymphocytes, des fibroblastes, des keratinocytes,
une libération des facteurs de croissance sanguins
une oxygénation cellulaire et une synthèse de l’Adénosine Tri Phosphate (A.T.P.)
une transformation des fibroblastes en myofibroblastes et une synthèse du collagène.
La synthèse de l’Adénosine Tri Phosphate est particulièrement importante, l’A.T.P. fournissant l’énergie nécessaire aux réactions chimiques du métabolisme cellulaire.
L’A.T.P. est la réserve d’énergie de la cellule, il doit être produit en permanence par la chaine respiratoire cellulaire, les stocks étant consommés en quelques secondes.
C’est l’énergie du rayonnement laser sur les mitochondries qui permet la transformation de l’A.D.P. (Adénosine di phosphate) en A.T.P. avec augmentation de D.N.A. (Acide désoxyribonucléique) et augmentation de la mitose. (Division chromosomique des cellules eucaryotes)
La biostimulation des tissus cibles peut être effectuée jusqu’à une augmentation de température de ces tissus de l’ordre de 13° environ. Avec cette augmentation de température, l’énergie communiquée aux tissus donne une production de protéines de choc thermique (Heat shock proteins) (Desmons S 2008).
Les H.S.P. provoquent l’apparition de collagénase de type 1 qui favorise la réparation tissulaire.
Cette photobiostimulation est aujourd’hui appliquée avec succès dans les différentes phases cicatricielles des plaies osseuses. Les études réalisées par l’Université de Milan Bicocca ayant confirmé qu’un rayonnement laser pénétrant appliqué à des cellules souches mésenchymateuses provoque d’abord une augmentation de la multiplication des C.S.M. pendant 7 jours puis une différenciation nettement augmentée par rapport au groupe cellulaire non irradié (Etudes in vitro Université Milan Bicocca) (Fudjimoto et al) (Leonida A et al 2011) .
4) Les effets ablatifs
Ils sont utilisés principalement lors de la préparation des sites osseux receveurs (ondes de choc et microplaies osseuses) et réalisés avec les lasers Er YAG (2940 nm) ou ErCrYSGG (2780 nm) très utiles pour obtenir l’arrivée des cellules sanguines sur le site de régénération.
La libération de certains lambeaux peut également être obtenue avant fermeture des berges, par l’action ablative de lasers médicaux.
5) Apport des lasers dans les événements indésirables post chirurgicaux
Les effets décrits dans ce chapitre (thermiques, photodynamiques et biostimulants) permettent de résoudre simplement de nombreux incidents post chirurgicaux :
cicatrisation rapide des tissus mous
soulagement des douleurs post chirurgicales (DSI Implantologie, etc. …)
guérison des surinfections diverses (alvéolites, péri implantites, etc. ….)
Ces effets ont trouvé une application essentielle dans les suites opératoires des régénérations osseuses, quelque soit le type de greffons utilisés (fig. 15)
Fig.15 – Traitement et guérison des incidents postopératoires
Lorsque la fermeture épithéliale d’un site greffé (avec ou sans implantologie conjointe) n’est pas parfaite (Fig. 15a), la vasodilatation et la photothérapie dynamique, effectuées en quelques minutes sans anesthésie, permettent d’obtenir une décontamination en profondeur complétée par un caillot sanguin superficiel (Fig. 15b).
L’ensemble favorise une fermeture rapide de l’épithélium (fig. 15c) sous réserve de l’utilisation conjointe d’un partiel amovible ou d’une plaque protectrice convenablement arrondie dans l’intrado pour ne pas écraser le greffon au niveau crestal.
https://www.facebook.com/LSjournalstomatoimplanto/posts/1078441319261347 II. LES PRINCIPES A RESPECTER
L’utilisation des lasers médicaux ne dispense nullement du respect des principes fondamentaux de toute intervention chirurgicale.
A. LA PREPARATION A L’INTERVENTION
1. Importance des études initiales
Une anamnèse complète du patient permet de diminuer les risques grâce au diagnostic des patients à risque (diabète, cirrhose, …) lors du bilan biologique effectué qui doit comprendre au minimum : numération NFS + bilan d’hémostase + bilan phosphocalcique + dosage des transaminases, du cholestérol, de l’urée, etc….
Les patients retenus pour des greffes osseuses (autogènes, allogènes, ou xénogènes) font partie du groupe sain sans pathologie à risque (ASA 1) ou à pathologie stabilisée ne représentant pas de risques importants pour le patient (ASA 2).
Une étude bactériologique (microscope à contraste de phase + sonde ADN) permet de vérifier que la flore bucco dentaire est compatible avec l’intervention envisagée.
2. Propositions des différents plans de traitement adaptés au patient
Dans ces nouvelles techniques chirurgicales, il semble important d’informer et de proposer aux malades les différentes possibilités, simples ou complexes, qui sont envisageables dans leur cas, même si certaines ne relèvent pas de notre propre compétence.
Ces différentes possibilités sont soumises à l’étude du patient en lui laissant un temps suffisant de réflexion.
3. Préparation de l’intervention
L’étude clinique parodontale confirmée par l’étude bactériologique, permet de définir si la régénération osseuse lasers assistée peut être effectuée directement ou si une remise en état parodontale est préférable avant la chirurgie osseuse.
En cas de flore parodontale pathogène, un traitement parodontal décontaminant complet est mis en œuvre avant la chirurgie (Rey G 2000 et 2001) (Rey G 2009) (Rey G, Missika P. 2010).
Si la flore parodontale est compatible avec l’intervention chirurgicale, c’est une simple remise en état de la cavité bucco dentaire qui est effectuée suivant les principes généraux de la maintenance parodontale décrit dans la « Lettre de la Stomatologie » - Spécial ADF 2014 – N°64 (Rey G 2014)
(fig 16 et 17)
Fig. 16 – Le combiné Air Flow master Piezon (EMS) amène une aide précieuse
à une remise en état bucco dentaire avant chirurgie
Fig.17 – Préparation parodontale avant intervention chirurgicale
4. Préparation des prothèses amovibles
La régénération osseuse par biomatériaux nécessite la mise en place d’une plaque de protection parfaitement stabilisée qui immobilise le greffon dans la position prévue.
Un partiel amovible en résine a le double avantage de remplacer les dents absentes et donc de reconstituer les conditions esthétiques et fonctionnelles nécessaires à la vie sociale.
Il reste la meilleure des solutions sous réserve d’avoir été parfaitement préparé pour être stable, équilibré et non compressif au niveau crestal.
Dans la majorité des cas d’édentation partielle, il est possible de préparer cette prothèse adjointe à l’avance (fig. 18).
Par contre, dans des cas de reconstruction importante ou totale (un maxillaire complet, par exemple), cette prothèse doit être élaborée après les 8 premiers jours de cicatrisation, c’est donc une éviction sociale d’environ 10 à 15 jours qui est nécessaire pour le patient.
Fig.18 – Reconstitution du volume osseux nécessaire à 6 dents :
Mise en place immédiate de la prothèse amovible de contention
Pour la préparation de ces prothèses, une collaboration étroite avec l’équipe du laboratoire de prothèses est nécessaire afin qu’ils élaborent celles ci dans le but de remplacement des dents absentes, mais également avec l’obligation orthopédique de protection et immobilisation du greffon osseux. (Fig. 19). Un appui muqueux suffisant facilite la stabilité impérative de cette prothèse transitoire.
Fig. 19 – Résultat à 6 mois postchirurgical de la reconstitution d’un maxillaire complet
B. LE DEROULEMENT DE LA CHIRURGIE
1. Préparation et décontamination du site d’intervention
a) l’acte chirurgical
Il est effectué suivant les principes habituels de la chirurgie bucco dentaire avec les extractions nécessaires, le décollement des lambeaux et le curetage minutieux de toutes les alvéoles et de toutes les lésions intra osseuses. (fig. 20A)
Les tissus de granulation et les foyers kystiques subissent une exérèse méticuleuse, mais les volumes osseux résiduels sont conservés au maximum en fonction de l’anatomie prévisionnelle de la reconstruction en cours.
b) Rôle des lasers et choix des longueurs d’onde (Rey G 2012)
Les extractions effectuées et le curetage des lésions nécrotiques laissent présager une contamination de l’os environnant. La chirurgie est donc suivie d’une décontamination des volumes osseux suivant le protocole de photothérapie dynamique sous peroxyde d’hydrogène.
Les tissus osseux sont d’abord oxygénés par dépôt de peroxyde d’hydrogène à 3 %, l’eau oxygénée étant laissée en place pendant plusieurs minutes afin de permettre une oxygénation des tissus en profondeur.
Le rayonnement laser est ensuite activé à l’intérieur des lésions, un déplacement constant permettant d’irradier l’ensemble des tissus durs et mous du site d’intervention (fig. 20B)
Fig. 20 –
A. Traitement chirurgical préparatoire B. Traitement décontaminant laser assisté
Les longueurs d’onde pour cette décontamination en profondeur doivent être pénétrantes et l’impact thermique du rayonnement laser doit être maitrisé pour éviter toute échauffement supérieur à 13° environ.
Les lasers diodes représentent aujourd’hui le rayonnement idéal pour ce type de décontamination en raison de leur faible puissance de crête et de la précision qu’ils offrent dans le réglage des temps de pulse et des temps de repos.
Le nouveau Diode Wiser Icon (Lambda - Kaelux) a été mis au point en partenariat avec les équipes scientifiques universitaires de Paris et de Milan. Le réglage en photothérapie dynamique (PDT moyen) permet une action très pénétrante et peu thermique sur les tissus osseux (fig.21) :
Réglage puissance de crête : 2,5 Wattts
Temps de pulse : 50 microsecondes
Temps de repos : 117 microsecondes
Puissance moyenne : 0,8 watt
Fréquence : 6000 Hz
Fig. 21 – Réglage utilisé pour une décontamination osseuse en profondeur par PDT sans colorant
2. Préparation des surfaces osseuses
a) l’acte chirurgical
Dans le cas de la présence d’une surface osseuse corticalisée, il est nécessaire de perforer cette corticale pour mettre en communication le biomatériau avec l’os trabéculaire mieux irrigué.
Les fraises boules chirurgicales peuvent être utilisées dans certains cas pour préparer de grosses communications avec l’os spongieux. Cette préparation initiale est complétée par l’utilisation du laser Er YAG qui permet de multiples plaies osseuses sans aucun échauffement du tissu osseux, chacune de ces micro plaies osseuses ayant un pouvoir d’attraction des cellules ostéogéniques vers le site greffé.
Dans la majorité des cas, les lasers Er :YAG (ou Er :Cr,YSGG) permettent une communication suffisante entre l’os spongieux et les matériaux de régénération osseuse placés (fig. 22)
Fig. 22 – Préparation d’une corticale osseuse dense avec le laser Er :YAG Pluser
b) Rôle des lasers et choix des longueurs d’onde (Rey G 2012)
Le rayonnement laser doit rester très superficiel, c’est donc les lasers Er :YAG (2940 nm) ou Er :Cr,YSGG (2780 nm) qui sont utilisés. Ce sont les seuls lasers utilisables en sécurité sur les tissus durs dentaires et osseux grâce à leur faible pénétration et au spray de refroidissement qui accompagne le rayonnement laser. Les effets ablatifs sont directement visibles sans échauffement en profondeur des tissus irradiés.
Pour ce travail, le laser Er YAG Pluser (Lambda – Kaelux) est réglé suivant les cas entre 200 et 250 Mj par impulsion avec une fréquence variable de 10 à 25 Hz environ.
Ce laser très efficace (peut monter jusqu’à une puissance de 12 watts et une fréquence de 100 Hz) possède surtout un système de réglage air / eau extrêmement précis qui permet d’adapter le spray en fonction de la teneur en eau des tissus cibles. (Fig. 23)
Fig. 23 – Nouvel Er YAG « Pluser » : Jusqu’à 12 w et 100 Hz
3. Le prélèvement sanguin
L’utilisation sur le site de régénération des protéines et facteurs de croissance favorables à la cicatrisation (Chapitre 1) nécessite un prélèvement sanguin qui est effectué habituellement avec des aiguilles épicrâniennes courtes (20 mm environ) munies d’ailettes de préhension. (fig.24)
Le système vacutainer permet d’adapter les tubes de prélèvement sous vide destinés à la centrifugation. Nous utilisons les tubes rouges dit « tubes secs » sans anti coagulant.
Fig. 24 - Le bon positionnement de l’aiguille est directement visible dans la tubulure transparente
Ce prélèvement sanguin peut être effectué au début de l’intervention lorsque celle ci ne dépasse pas une heure trente environ mais il est préférable de l’effectuer dans l’heure qui précède son mélange avec le biomatériau.
Le système intra-spin qui équipe l’Institut clinique de Garancière permet de centrifuger 8 tubes en même temps ce qui est, en général, largement suffisant pour la grande majorité des interventions.
La centrifugation à 3000 tours pendant 11 minutes permet de récupérer les caillots de fibrine après avoir séparé les hématies. (Fig. 25) (Mole C 2006)
Fig. 25 – Les prélèvements sanguins et la préparation des biomatériaux sont au programme du cursus d’enseignement
4. La préparation du biomatériau
Les caillots de fibrine riche en plaquettes sont d’abord récupérés et séparés des hématies. La portion inférieure du caillot (au contact des hématies) est coupée et conservée dans une cupule stérile alors que le reste du caillot est placé dans une boite perforée destinée à comprimer ces caillots et obtenir des membranes PRF en récoltant dans la partie inférieure l’exsudat plasmatique riche en fibronectines (Fig. 26 et 27) – (Caccianiga et al 2005)
Fig. 26 – Séparation des hématies et récupération de la artie inférieure du caillot de PRF Fig. 27 – Compression des caillots pour l’obtention des membranes PRF
Pendant le temps de compression des caillots de fibrine, les parties prélevées sont finement découpées en morceaux de très petit volume pour être mélangées au biomatériau (Bio-oss granules fins) préalablement placé dans du sérum physiologique additionné de métronidazole (fig. 28)
Fig. 28 – Mélange des petits morceaux de PRF avec les granules de Bio Oss
Des copeaux osseux autogènes prélevés directement sur le site d’intervention sont ensuite mélangés aux biomatériaux.
Lorsque la compression des membranes de PRF est terminée, l’exsudat plasmatique récolté vient remplacer le sérum physiologique dans le mélange de biomatériaux et l’ensemble bien homogénéisé est laissé au repos jusqu’à utilisation.
5. Décontamination finale du site receveur
a) Réglages des lasers
Cette décontamination des volumes osseux résiduels est obtenue avec un rayonnement laser pénétrant dont le réglage des temps de pulse et de repos permet une relaxation thermique des tissus cibles pour ne pas élever la température au dessus de l’effet de vasodilatation.
Dans cet objectif, les temps de pulse sont au maximum de 30 % de la période et les temps de repos de 70 %.
Le choix d’une puissance de crête inférieure à 2,5 w permet de conserver une puissance moyenne inférieure à 0,8 w compatible avec le respect des tissus vivants.
b) Lasers et Oxygène singulet
Découvert en 1924, l’oxygène singulet est 1000 fois plus actif que l’oxygène fondamental. Il est un intermédiaire universel dans les processus physiques, cliniques et biologiques des réactions moléculaires.
Il est produit par le rayonnement laser grâce au transfert d’énergie depuis une molécule excitée photoniquement par le Dioxygène (oxygène fondamental).
Sa durée de vie dans nos tissus est de l’ordre de la microseconde avant de se transformer en oxygène triplet puis de revenir à la molécule d’oxygène fondamental O2 disponible pour une nouvelle excitation photonique.
Cette brièveté d’existence est compensée par une fréquence très élevée des lasers Diodes utilisés (6000 Hz ou plus).
Le pouvoir décontaminant de cette PDT sans colorant a été découvert en Parodontologie et en Implantologie dans les années 90 et décrit pour la première fois en 2000 (Rey G 2000).
L’oxygénation des tissus est obtenue par dépôt préalable de peroxyde d’hydrogène à 3 %. L’eau oxygénée claire et incolore ne diminue pas la pénétration du rayonnement laser.
Ce liquide est, chez l’humain, un produit normal du métabolisme aérobique, il pénétre les membranes muqueuses et se décompose très rapidement en oxygène et en eau sous l’action des peroxydases des organismes vivants aérobies.
Cette PDT sous eau oxygénée est aujourd’hui très largement utilisée dans de nombreux domaines médicaux.
6. Mise en place de la xénogreffe de la reconstruction
Lorsque nous reprenons le biomatériau après la préparation du site receveur, les excès de liquide sont aspirés avec précaution pour ne conserver que le biomatériau rendu malléable par son mélange préalable avec l’exsudat plasmatique.
Cette consistance permet de le placer facilement dans toutes les anfractuosités sans avoir à exercer des forces top importantes avec les fouloirs chirurgicaux.
La porosité du Bio-oss, dont l’anatomie est très proche de l’os humain, facilite la néo vascularisation et l’arrivée des cellules ostéogènes.
Le biomatériau doit être placé sur le site receveur en présence de sang. La finesse des granules et la présence des facteurs de croissance facilitent la résorption de la xénogreffe et son remplacement progressif par un os naturel régénéré (Fig. 29)
Fig. 29 – La mise en place du biomatériau est réalisée en présence de sang
7. La photo biostimulation postchirurgical immédiate
a) Le choix du laser.
Les lasers Diodes munis de lentille défocalisante peuvent être utilisés en postopératoire immédiat, l’action antalgique, anti inflammatoire et biostimulante du rayonnement laser ayant une action très favorable sur les suites opératoires immédiates après tout acte chirurgical. (Hakki SS et al 2010)
Les lasers Diodes Wiser et Wiser Icon ont un programme spécifique pour cette utilisation (Fig.30)
Fig. 30 – Les lasers Diodes permettent une biostimulation post chirurgicale favorable aux suites opératoires simples
b) Les réglages conseillés
L’anesthésie locale ou régionale étant encore active, le patient ne peut pas signaler les élévations de température trop importantes.
Il est donc nécessaire de choisir, en post chirurgical immédiat, le réglage de photostimulation faible qui donne une puissance de crête de 3 watts mais un temps de pulse de 50 microsecondes avec un temps de repos de 50 microsecondes.
La puissance moyenne est réduite à 1,5 watts avec une fréquence de 10.000 Hertz qui procure une grande énergie aux photons (Constante de Planck X Fréquence) (Fig. 31).
Fig. 31 – Les nouveaux réglages de photostimulation du laser Diode Wiser Icon
C. Le suivi postopératoire
1. Obtenir une contention stable et non compressive
Les patients sont revus au minimum à 24 ou 48 heures puis à 8 jours postopératoires afin de vérifier la première cicatrisation et la bonne adaptation de la prothèse transitoire si celle ci a été placée directement après l’acte chirurgical.
Les prothèses amovibles transitoires doivent toujours privilégier un retour vestibulaire qui englobe le greffon et surtout une stabilité parfaite par la présence d’un appui palatin correct pour le maxillaire ou d’un appui muqueux large pour la mandibule.
La résine de rebasage est creusée au niveau crestal avec un arrondi non compressif qui permet une bonne cicatrisation anatomique de la muqueuse et de la greffe.
2. Les photo biostimulations conseillées en postopératoire
Pendant ces séances de contrôle, une biostimulation est, en général, effectuée en PDT moyenne (ou faible si des sensibilités thermiques sont ressenties). (Fujimoto K et al 2010).
Les biostimulations sont effectuées par période de 30 secondes avec des temps de repos de 30 secondes entre chaque séquence de tirs.
La lentille défocalisante balaie le site opératoire à une distance d’environ 1 à 2 cm de la surface cible en irradiant un secteur assez large sur les faces vestibulaires et sur les faces palatines ou linguales.
Les temps de repos sont importants. Aucun effet thermique douloureux ne doit être ressenti par le patient.
Le temps global d’irradiation (repos non compris) est d’environ 2 à 4 minutes suivant l’étendue du site opératoire (4 mn ou plus pour une hémi arcade complète). (Fig. 32)
Fig. 32 – Les photostimulations sont effectuées chaque 15 jours pendant 2 mois environ
Les travaux de Milan Bicocca sur les cellules souches mésenchymateuses ont utilisés un rayonnement pénétrant légèrement défocalisé à une puissance moyenne de 1,5 watt. (Fig. 33) (Leonida et al 2011)
Fig. 33 – Evaluation de l’action des lasers sur les cellules souches mésenchymateuses
L’évaluation à 7 jours et 14 jours a montré une augmentation de la prolifération pendant les 7 premiers jours, suivie d’une augmentation de la différenciation pendant les 7 jours suivants pour le groupe ayant subi l’irradiation laser par rapport au groupe témoin. (fig. 34)
Fig. 34 – Résultats : augmentation de la prolifération pendant 7 jours,
puis augmentation de la différenciation pendant 7 jours
III. Les 12 étapes du protocole proposé
La synthèse des constatations précédentes dans les paragraphes I et II permet de proposer un protocole applicable dans la très grande majorité des reconstructions préimplantaires que nous sommes amenés à réaliser en cabinet libéral ou en clinique.
Étape 1 : Prélèvement sanguin et centrifugation
Les prélèvements sanguins sont en général effectués sur la face interne de l’avant bras soit sur la veine céphalique qui se trouve coté extérieur de l’avant bras, soit sur la veine basilique qui se trouve du coté intérieur.
Ces prélèvements sont d’une grande simplicité mais nécessitent une formation qui est prévue en séminaire perfectionnement. (fig. 35A)
Fig. 35 – Prélèvement sanguin avec aiguille épicranienne et système vacutainer
La centrifugation doit être mise en route immédiatement après le prélèvement sanguin (fig. 35B), et si ce prélèvement est long, il est conseillé de commencer la centrifugation avec les 4 premiers tubes pour replacer ensuite les 4 tubes suivants et terminer la centrifugation avec l’ensemble des tubes pendant 11 minutes.
NOTE : le prélèvement sanguin et la centrifugation sont effectués au départ pour les interventions de courte durée mais peuvent être retardés afin d’utiliser la fibrine riche en plaquettes dans un délai raisonnable (30 minutes à 1 heure) après la récolte du PRF.
Etape 2 : Préparation des caillots de fibrine riche en plaquettes
Fig. 36 – Traitement des caillots de PRF pour utilisation avec le biomatériau
Après centrifugation, la gestion des caillots de fibrine comprend 3 points essentiels faciles à réaliser (Fig. 36)
a) séparer et jeter les hématies, puis prélever et conserver la petite partie inférieure des caillots
b) couper en multiples petits morceaux la partie inférieure des caillots
c) comprimer les caillots de fibrine pour obtenir des membranes PRF
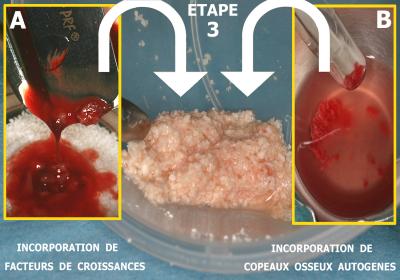
Etape 3 : Préparation du biomatériau
Après une découpe en très fines particules, la partie inférieure des caillots de fibrine est incorporée aux granules de Bio-oss (fig. 37A).
Le sérum physiologique dans lequel a séjourné le biomatériau peut être remplacé par l’exsudat obtenu en morcelant la fibrine riche en plaquettes.
Fig. 37 - Le biomatériau s’obtient pas un mélange de Bio-oss granules fins + PRF + copeaux osseux autogènes
L’os naturel du site chirurgical sert à récolter des copeaux osseux autogènes grâce à de petits rabots stériles à utilisation unique. Ces copeaux sont mélangés au biomatériau préparé (Fig. 37B)
Etape 4 : Préparation des surfaces osseuses du site receveur
Fig. 38 – Préparation d’une corticale épaisse par perforations (fraise chirrugicale + Laser Er YAG)
Il est préférable d’effectuer cette étape avec un laser Er :YAG (ou Er :Cr,YSGG) pour obtenir une quantité suffisante de communications entre le greffon et l’os trabéculaire : par exemple, une fréquence de 20 Hz pendant 20 secondes donne 400 micro plaies osseuses favorables à l’arrivée des facteurs de croissance et des cellules sanguines.
L’utilisation d’une fraise boule chirurgicale peut précéder l’utilisation de l’Erbium dans certains cas de corticales épaisses où des communications larges sont souhaitables. (fig. 38)
NOTE : Attention à l’utilisation de la Piezzo chirurgie qui est possible pour obtenir des ondes de chocs intra osseuses. Les ultrasons à haute fréquence pénètrent profondément dans les tissus osseux et seule la partie superficielle est refroidie avec le spray. L’énergie vibratoire ultrasonique est transformée en chaleur dans la profondeur des tissus cibles. Des temps de repos sont nécessaires dans le cas d’une utilisation prolongée où les inserts sont placés perpendiculairement à la surface des tissus cibles.
Etape 5 : Décontamination finale du site receveur
Après la chirurgie de curetage et la préparation des corticales osseuses, il est conseillé d’effectuer une décontamination finale avant de déposer le biomatériau.
L’ensemble du site chirurgical est oxygéné par dépôt de peroxyde d’hydrogène à 3 % et l’action décontaminante est obtenue par photothérapie dynamique grâce à un laser diode réglé suivant les indications décrites plus haut (PDT moyenne).
Fig. 39 – La PDT finale effectuée amène également un saignement sur le site osseux receveur
Etape 6 : Mise en place du biomatériau
Le biomatériau ne doit pas être placé sur un site receveur sec. Il est nécessaire d’obtenir un saignement abondant avant la mise en place et le modelage de la xénogreffe. (fig. 40)
Le dépôt du biomatériau est effectué avec une spatule plus ou moins large suivant la facilité de l’accès au site. Les granules sont ensuite foulés dans les anfractuosités osseuses sans pression excessive. Il convient d’alléger au maximum la force exercée sur les fouloirs chirurgicaux lorsque les sites greffés correspondent à des zones à risques (membrane de Schneider, canal mandibulaire, etc. …).
Fig. 40 – Reconstitution d’un maxillaire complet par Bio-oss + PRF + copeaux osseux
Etape 7 : Modelage et maintien initial du greffon
La reconstitution de l’anatomie osseuse est une phase délicate particulièrement lorsqu’il s’agit d’une reconstruction maxillaire complète (Fig. 39. 40. 41.42. 43.).
Les membranes PRF placées sur le biomatériau vont permettre un premier maintien et un premier modelage. Leur répartition sur l’ensemble de la xénogreffe vient libérer pendant 7 jours les cytokines et facteurs de croissance favorables à la régénération programmée.
Fig. 41 – Remodelage et maintien initial du biomatériau avec les membranes PRF
Etape 8 : Protection par des membranes collagènes
Des membranes collagènes résorbables Biogide (Geistlich) sont placées au dessus des membranes PRF pour une meilleure protection, particulièrement dans les cas où la fermeture hermétique des berges gingivales est délicate ou impossible.
NOTE : dans tous les cas où nous n’avons pas placé de membrane collagène en complément des membranes PRF, le résultat de la cicatrisation est plus aléatoire.
Fig. 42 - Protection de l’ensemble du greffon par des membranes collagènes résorbables
Etape 9 : Fermeture des berges gingivales sans tension excessive
Le sang reste un élément indispensable à la cicatrisation de la chirurgie reconstructrice. Des tensions excessives au niveau des sutures empêchent une bonne vascularisation par l’intermédiaire des tissus mous périphériques. Or, ces tissus gingivaux sont l’origine d’un apport sanguin possible pour tout le volume du greffon.
Il semble préférable d’éviter des tractions importantes qui peuvent être la cause d’une ischémie des berges gingivales, et consécutivement d’une hypovascularisation de la superficie des greffons.
Fig. 43 – La fermeture des bords gingivaux ne doit pas perturber la vascularisation de ces berges.
Etape 10 : Photo biostimulation du site opératoire
La biostimulation des sites greffés est conseillée en postopératoire immédiat avec un réglage « faible » (1,5 w de puissance moyenne) puis à chaque visite de contrôle et au minimum chaque 15 jours pendant les deux mois suivants l’intervention avec un réglage « moyen » de :
puissance de crête : 4 w
Ton : 50 microsecondes
Toff : 50 microsecondes
Fréquence : 10.000 Hz
Soit donc une puissance moyenne de 2 watts
Fig. 44 – Les sites d’intervention sont photostimulés chaque 2 semaines pendant 8 semaines
Cette énergie photonique est appliquée avec une lentille défocalisante pendant des périodes de 30 secondes espacées de temps de repos identiques. Les études in vitro de Milan Bicocca confirment la stimulation cellulaire obtenue dans les phases de prolifération et de différenciation grâce à l’application biostimulante du rayonnement laser.
Etape 11 : Immobilisation des biomatériaux ostéo-inducteurs
Les prothèses de contention sont placées le plus tôt possible et très fréquemment en postopératoire immédiat. Les prothèses sont rebasées au fur et à mesure de la cicatrisation de la crête en prenant garde de ne jamais comprimer le greffon au niveau crestal.
Même dans le cas d’une reconstruction maxillaire complète, une prothèse transitoire est placée à 10 jours postopératoires environ avec un intrados bien arrondi et creusé au niveau crestal pour éviter toute compression et permettre une cicatrisation correcte des tissus mous et des tissus durs (Fig. 45)
Fig. 45 – Dans ce cas délicat, la prothèse transitoire est placée à 12 jours postopératoires
Etape 12 : Délai d’attente pour obtenir un os mature bien vascularisé
Le délai minimum de résorption et de reconstruction osseuse semble de 8 mois minimum dans les conditions de ce protocole. Ce temps correspond à la bonne maturation d’un os néoformé bien vascularisé.
Dans le cas de greffes complexes, il est préférable de prévoir un délai de 9 à 10 mois environ, voire plus.
Le cas décrit sur la figure 46 montre les résultats cliniques et radiographiques après 6 mois d’attente. A ce stade, l’intervention finale est prévue mais ne sera réalisée que trois mois plus tard pour respecter le délai biologique de cet important greffon.
Fig. 46 - Résultats cliniques et radiographiques obtenus à 6 mois sur un effondrement maxillaire de 25 mm
IV. L’ELABORATION DES PROTHESES D’USAGE
A. LES OBLIGATIONS
La biologie osseuse nécessite un minimum de 8 mois avant l’utilisation implantaire ou prothétique de l’os néoformé.
Les plans de traitements prothétiques envisageables ne sont donc proposés aux patients qu’après cette période de cicatrisation et après vérification clinique, radiographique et bactériologique des traitements effectués avant et après la régénération osseuse.
Un tissu osseux maxillaire ou mandibulaire qui se dégrade et se résorbe est souvent la conséquence d’une maladie infectieuse.
Comme toute pathologie d’origine bactérienne, celle-ci peut récidiver, parfois très rapidement.
Il convient donc de mettre tout en œuvre et d’informer les patients sur les obligations qui suivront la cicatrisation osseuse et la mise en place des solutions prothétiques choisies par ceux ci.
Le facteur de risques doit être évalué pour chaque malade et fera l’objet d’une vérification annuelle ou biannuelle avec contrôle de la flore sous gingivale par analyse du biofilm sous microscope à contraste de phase. (fig.47)
Cet examen bactériologique très simple s’effectue en quelques minutes et paraît aujourd’hui indispensable à chaque contrôle clinique.
Fig. 47 – Le microscope bactériologique, un élément indispensable au cabinet dentaire
B. LA CONCEPTION PROTHETIQUE
Il appartient à chaque praticien d’établir un plan de traitement prothétique bien adapté à chaque situation et particulièrement aux habitudes de mastication et d’hygiène bucco dentaire des patients.
Même si nous arrivons à rectifier quelques mauvaises pratiques, il est fréquent qu’elles réapparaissent par la suite avec des conséquences qui peuvent être nuisibles à nos traitements.
L’expérience a montré que la modestie est souvent bonne conseillère, les plans de traitement prothétique simples peuvent allier les exigences esthétiques et les contraintes fonctionnelles, et s’avérer d’une fiabilité rassurante pour le patient, comme pour le praticien ….
En fonction de tous ces critères, (prothèses, patients, biofilm, etc. …), une hygiène bucco dentaire précise est adaptée et indiquée à chaque malade. Elle devra être suivie avec rigueur quotidiennement (Rey G 2013. L.S. N°60 « Simplicité et efficacité en H.B.D. »).
Une maintenance complète est proposée chaque année (ou chaque 6 mois) avec un temps suffisant pour diagnostiquer et résoudre tout problème parodontal ou péri implantaire en plus de la remise en état dentaire et prothétique (Rey G. 2014. L.S. n°64 « La maintenance parodontale »).
C. LES ERREURS A ÉVITER
1) Elles peuvent avoir des origines chirurgicales :
mauvais diagnostic initial (clinique ou radiographique)
décontamination du site chirurgical insuffisante
mauvaise préparation des surfaces osseuses greffées
échauffement trop important des tissus osseux
réinfection postopératoire du greffon
élaboration inadaptée des prothèses de contention provisoires
délai d’attente trop court avant la suite du traitement
Toutes les notions et principes énoncés dans cet article permettent d’éviter ces maladresses qui peuvent aboutir à l’échec du traitement chirurgical.
2) Elles peuvent avoir une origine prothétique :
a) une prothèse implanto portée élaborée suivant la figure 48 a toutes les chances de poser de sérieux problèmes au patient, surtout si la régénération osseuse antérieure est consécutive à une maladie parodontale agressive.
L’os régénéré, quelque soit le type de reconstruction ou de greffe, semble moins résistant que l’os natif d’origine, aux forces de traction ou de pression latérales
Dans le cas de la figure 48, l’implantologie aurait du être étendue latéralement pour avoir une résistance tri dimensionnelle plus favorable ou, être remplacée par une prothèse amovible stabilisée.
Fig. 48 – les extensions sont à éviter au maxillaire
b) la figure 49 montre le cas d’une erreur de conception esthétique et fonctionnelle des prothèses amovibles effectuées après une double greffe osseuse mandibulaire.
L’instabilité des prothèses a engendré la résorption totale des greffons et l’abandon de l’hygiène bucco dentaire par la patiente a aggravé ce tableau désastreux (fig. 40 A.B.C.D.)
Fig. 49 – L’abandon de l’hygiène bucco dentaire aggrave les erreurs prothétiques
Après reprise des greffes par régénération osseuse lasers assistée, une nouvelle implantologie est effectuée pour stabiliser deux prothèses amovibles d’usage réalisées suivant les concepts fonctionnels et esthétiques habituels (fig. 50 A.B.C.).
Fig. 50 – Les régénérations osseuses sont maintenues par des prothèses amovibles stabilisées.
V. CONCLUSIONS SUR LE PROTOCOLE
`
Au même titre que les tissus dentaires et parodontaux, les tissus osseux maxillaires et mandibulaires font partie des domaines d’activité habituels d’un cabinet libéral d’odontostomatologie.
Les greffes autogènes ou les régénérations osseuses rendent de grands services aux patients et les techniques lasers assistées appliquées à cette chirurgie permettent des reconstructions osseuses qui semblaient inaccessibles auparavant.
Le protocole décrit dans cet article permet tout type de reconstruction osseuse maxillaire ou mandibulaire par apposition crestale ou par voie intrasinusienne.
Les gains osseux obtenus sont souvent supérieurs à 10 mm en hauteur et à 6 mm en largeur avec de bons résultats sur certains effondrements de 20 mm ou plus.
Les conditions de réussite du protocole proposé sont strictes et nécessitent une préparation parodontale rigoureuse accompagnée du respect des principes chirurgicaux décrits au paragraphe II.
C’est ainsi pour toutes les techniques lasers assistées, leurs utilisations ne dispensent pas des bonnes pratiques universitaires avérées.
LS 68, Spécial ADF 2015
Gérard REY
Paris Garancière
Paris 7 Diderot
Milan Bicocca
Lire aussi sur le sujet :
La maintenance parodontale : acte essentiel aprés traitement des parodontites et peri implantites
Simplicité et efficacité en hyguène bucco-dentaire
Place des lasers en Esthétique bucco dentaire quotidienne
Influence de l’utilisation d’un laser diode dans l’extraction des dents de sagesse incluses
BIBLIOGRAPHIE
Anagnostou F, Ouhayoun JP. Valeur biologique et nouvelles orientations dans l’utilisation des matériaux de substitution osseuse. J. Parodontol Implantol Orale 2000 ; 19,3 : 317-343.
Caccianiga GL, Monguzzi R, Rey G, Martelli S. Srgie entre laser et PRP dans la régénération osseuse. Alpha Omega News 2005 ; Sept. : 4-7.
Choukroun J, Adda F, Schoeffler C, Vervelle A. Une opportunité en paro implantologie, le PRF. Implantodontie 2001 ; 42 : 55-62.
Colombier ML, Lesclous P, Tulasne JF. La cicatrisation des greffes osseuses. Revue Stomato Chir Maxillo faciale 2005 ; 106 : 157-165.
Desmons S. « Préconditionnement laser en site osseux membraneux ». Thèse doctorat d’université 2008.
Fujimoto K, Kiyosaki T, Mitsui N, Mayahara K, Omasa S, Suzuki N et al. Low intensity laser irradiation stimulates mineralization via increased BMPs in MC3T3-E1 cells. Photomed Laser Surg 2010 ; 28 : S167-72.
Giannoudous P, Dinopoulos, Eleftherios T. Bone subsitutes : an update. Injury 2005 ; 36,3 suppl 1 : S20-S27.
Hakki SS, Bozkurt SB. Effects of different setting of diode laser on the mRNA expression of growth factors and type I collagen of human gingival fibroblasts. Photomed Laser Surg 2010 ; 28 : 82.
Hynes K, Menicanin D, Gronthos S, Bartold PM. Clinical utility of stems cells for periodontal regeneration. Periodontol 2000. 2012 ; 59(1) : 202-27.
Jayakumar A, Rajababu P, Robini S, Butchibabu K, Naveen A, Reddy PK, Vidyasagar S, Satyanarayana D, Kumar SP. Multicentre, randomized clinical trial on the efficacy and safety of recombinant humanplateled-derived growth factor with b-tricalcium phosphate in human intra-osseous periodontal defects. J. Clin.Periodontol 2011 ; 38 : 163-172.
Leonida A, Paiusco A, Rossi G, Carini F, Baldoni M. Effects of low level laser irradiation on mesenchymal stem cells seeded on a three dimensional biomatrix : in vitro study. Italian Oral surgery 2011.
Mole C. Rôle des concentrés plaquettaires dans la cicatrisation et la régénération osseuse. JPIO 2006 ; 25 : 45-62.
Monnet-Corti, Roche-Poggi P. Principes biologiques mis en jeu dans la cicatrisation osseuse. J.Parodontol.Implant.Orale 2006 ; 25 : 5-13.
Precher HV. Bone Graft Materials. Dent Clin North Am 2007 ; 51,3 : 729-746.
Rey G. L’apport du laser dans le traitement des poches parodontales. Implantodontie sept.2000 ; 27-34.
Rey G. L’apport du laser dans les parodontites et les peri implantites. La lettre de la stomatologie 2001 ; avril : 6-9.
Rey G. “La chirurgie pré implantaire lasers assistée, quelle longueur d’onde choisir ?” L.S. nov. 2012 ; n°56 : 4-21.
Rey G, Missika P. « Les lasers et la chirurgie dentaire ». Ed CdP Coll JPIO 2010.
Rickert D, Sauerbier S, Nagursky H, Menne D, Vissink A, Raghoebar GM. Maxillary sinus floor elevation with bovine bone mineral combined with either autogenous bone or autogenous stem cells : a prospective randomized cliical trial. Clin. Oral impl. Res. 2011 ; 22 : 251-258.
Satyarayana D, Kumar SP. Multicentre, randomized clinical trial on the efficacy and safety of recombinant human plateled-derived growth factor with b-tricalcium phosphate in human intra-osseous periodontal defects. J. Clin Periodontol 2011 ; 38 : 163-172.
Thies RS, Bauduy M, McQuaid D et al. Bone morphogenetic protein alters W-20 stromal cell differenciation in vitro. J Bone Min Res 1990 ; 5 : S150.
Toriumi DM, Kotler HS, Luxenberg DP, Holtrop ME, Wang E. Mandibular reconstruction with a recombinant bone-inducing factor. Arch Otolaryngol Head Neck Surg 1991 ; 117 : 1101-12.
Ueda M, Yanada Y, Ozawa R, Okazaki Y. Augmentation de volume de crête simultanée à l’implantation grâce à l’ingeniérie tissulaire de cellules osseuses. Rapports de cas cliniques. Parodont Dent Rest 2005 ; 25 : 129-137.
Urist MR. Bone formation by autoinduction. Science 1965 ; 150 : 893-9.
Urist MR, Iwata H, Ceccotti PL et al. Bone morphogenesis in implants of insoluble bone gelatin. Proc Natl Acad SCI USA 1973 ; 70 : 3511-5.
Vainio S, Karanova L, JowettA, Thesleff I. Identifcation of BMPs as a signal mediating secondary induction between epithelial and mesenchymal tissues during early tooth development. Cell 1993 ; 75 : 45-58.