Pose d'implants chez les jeunes enfants - Indications et contre-indications
 La mise en place d’implants dentaires en cours de croissance constitue une thérapeutique complexe et exceptionnelle, allant à l’encontre de certains dogmes dans le champ de l’implantologie orale. Les indications des traitements implantaires précoces sont restreintes et correspondent aux oligodonties mandibulaires. Ces dernières constituent une anomalie du développement dentaire d’étiologie génétique, définie par l’absence congénitale d’au moins 6 dents. Dans ce travail, nous allons nous attacher à décrire les principales situations cliniques correspondant à cette pratique, les contre-indications, ainsi que les potentielles complications inhérentes à ces procédures chirurgicales.
La mise en place d’implants dentaires en cours de croissance constitue une thérapeutique complexe et exceptionnelle, allant à l’encontre de certains dogmes dans le champ de l’implantologie orale. Les indications des traitements implantaires précoces sont restreintes et correspondent aux oligodonties mandibulaires. Ces dernières constituent une anomalie du développement dentaire d’étiologie génétique, définie par l’absence congénitale d’au moins 6 dents. Dans ce travail, nous allons nous attacher à décrire les principales situations cliniques correspondant à cette pratique, les contre-indications, ainsi que les potentielles complications inhérentes à ces procédures chirurgicales.
Indications et contre-indications des implants symphysaires précoces
Auteurs F Clauss 1,2, F Obry 1,2, J-C Dahlet 2, M Metz 1, M-C Manière 1,2
1 : Faculté de Chirurgie Dentaire, Université de Strasbourg, Pôle de Médecine et de Chirurgie Bucco-Dentaires, Hôpitaux Universitaires de Strasbourg
2 : Centre de Référence pour les Manifestations Bucco-Dentaires des Maladies Rares, Strasbourg
Introduction
La mise en place d’implants dentaires en cours de croissance constitue une thérapeutique complexe et exceptionnelle, allant à l’encontre de certains dogmes dans le champ de l’implantologie orale. Les indications des traitements implantaires précoces sont restreintes et correspondent aux oligodonties mandibulaires. Ces dernières constituent une anomalie du développement dentaire d’étiologie génétique, définie par l’absence congénitale d’au moins 6 dents. Dans ce travail, nous allons nous attacher à décrire les principales situations cliniques correspondant à cette pratique, les contre-indications, ainsi que les potentielles complications inhérentes à ces procédures chirurgicales.
I) Contexte général
Les traitements implantaires en cours de croissance ont fait l’objet d’un avis favorable de la HAS en 2006 intitulé « Traitements des agénésies multiples liées aux dysplasies ectodermiques ou à d’autres maladies rares, chez l’enfant atteint d’oligodontie, avec pose de 2 implants (voire 4 maximum) uniquement dans la région antérieure mandibulaire au-delà de 6 ans et ce jusqu’à la fin de la croissance, après échec ou intolérance de la prothèse fonctionnelle ». Avant cette date, sur le plan international, des équipes pionnières ont décrit la mise en place d’implants symphysaires dans des contextes d’anodontie ou d’oligodontie mandibulaire associée à une dysplasie ectodermique hypohidrotique (Bergendal et coll., 1991, Alcan et coll., 2006, Kramer et coll., 2007, Aydenbelge et coll., 2013 ; Bergendal et coll., 2015) (Fig 1 : tableau radiologique d’une oligodontie sévère associée à une dysplasie ectodermique liée à l’X chez un patient âgé de 7 ans, Centre de Référence pour les Manifestations Bucco-dentaires des Maladies Rares de Strasbourg). Plus de 25 ans de suivi clinique et radiologique longitudinal sur les premiers cas décrits d’implantologie pédiatrique, ont permis de mettre en évidence une évolution favorable des implants durant la croissance, de bons résultats prothétiques et une absence de complications implantaires majeures (Fig 2: implants symphysaires ostéointégrés chez un patient âgé de 10 ans présentant une dysplasie ectodermique autosomique, Centre de Référence pour les Manifestations Bucco-dentaires des Maladies Rares de Strasbourg).
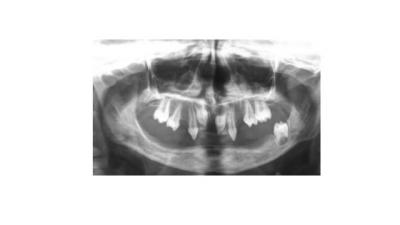
Fig 1 : tableau radiologique d’une oligodontie sévère associée à une dysplasie ectodermique liée à l’X chez un patient âgé de 7 ans (Centre de Référence pour les Manifestations Buccodentaires des Maladies Rares de Strasbourg).
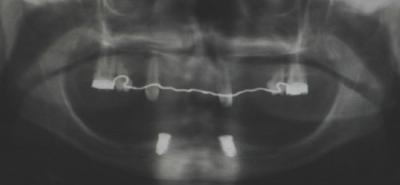
Fig 2 : implants symphysaires ostéointégrés chez un patient âgé de 10 ans présentant une dysplasie ectodermique autosomique (Centre de Référence pour les Manifestations Buccodentaires des Maladies Rares de Strasbourg).
Des cohortes plus larges ont été décrites, comme dans le travail de Kearns et coll. (1999), avec le suivi clinique et radiologique de 6 patients atteints d’oligodontie d’une moyenne d’âge de 11 ans. Dans cette étude, des implants symphysaires ont été posés (n=22), mais également des implants maxillaires en cours de croissance, ce qui ne correspond pas au consensus adopté en France (HAS, 2006). Une étude portant sur 168 implants symphysaires mis en place en cours de croissance, a montré un taux de survie implantaire de l’ordre de 90% à 6 mois post-opératoire et de 86% à 2 ans (Gückes et coll., 2002). Ces taux de survie implantaire s’avèrent toutefois inférieurs à ceux observés dans le groupe de patients en fin de croissance, qui étaient de l’ordre de 95%. Une étude plus récente portant sur 700 implants mis en place chez des patients atteints de dysplasie ectodermique (dont 25% d’enfants) a mis en évidence des taux de survie implantaire élevés, de l’ordre de 98%, aussi bien chez les patients en cours de croissance ou adultes (Wang et al., 2016). Une autre donnée intéressante est l’indication dans 70% des cas de greffes osseuses dans le cadre de la réhabilitation implanto-prothétique chez l’adulte atteint de dysplasie ectodermique.
II) Indications des thérapeutiques implantaires précoces
Les implants en cours de croissance et le protocole d’affection longue durée hors liste, tel qu’il a été défini par la HAS, concernent les patients présentant une oligodontie mandibulaire d’étiologie génétique, qu’elle soit isolée ou syndromique (Fig. 1). Un diagnostic moléculaire de l’oligodontie n’est pas indispensable pour obtenir la prise en charge dans le cadre de ce protocole, toutefois si des analyses moléculaires sont disponibles, elles doivent être intégrées à la demande. Le diagnostic de l’oligodontie doit être posé idéalement au sein d’un centre de référence ou de compétence maladies rares. La réhabilitation prothétique consistera systématiquement en une prothèse adjointe mandibulaire implanto-stabilisée en cas d’échec de traitement prothétique conventionnel. La fréquence de renouvellement prothétique doit être adaptée à la croissance squelettique.
II.1 Les critères d’indications des thérapeutiques implantaires précoces sont restreints et définis comme suit :
1) Oligodontie mandibulaire : absence congénitale d’au moins 6 germes de dents permanentes mandibulaires objectivée radiologiquement. Les oligodonties aussi bien isolées que syndromiques correspondent aux indications.
2) Implants dans la région symphysaire. La distribution topographique des agénésies dentaires doit permettre la mise en place d’implants symphysaires sans interférences avec les dents ou les germes présents.
3) Antécédents d’échec ou d’intolérance prothétiques.
4) Critère de maturité squelettique : la croissance ne doit pas être achevée, ce qui est objectivé par des méthodes radiographiques de détermination de la maturité squelettique (méthode de Greulich et Pyle sur une radiographie du poignet et de la main : analyse du carpe, du poignet et des régions épiphysaires distales).
II.2 Constitution du dossier de demande d’Affection Longue Durée (ALD) Hors liste pour oligodontie chez l’enfant
Ce dossier est constitué de trois pièces administratives et fait l’objet d’une expertise par un médecin-conseil de la CPAM. Il est constitué au sein d’un Centre de Référence ou de Compétence Maladies Rares ou par un praticien libéral, en coordination avec ces centres. La première pièce est la demande d’ALD Hors liste (fiche violette), qui doit être signée par le praticien faisant la demande, mais également par le médecin traitant. La pathologie doit être identifiée, avec des arguments cliniques. Les spécialités pharmaceutiques doivent être précisées, en l’occurrence il faudra mentionner « implants ostéointegrés selon CCAM (code LBLD066) pour le traitement des agénésies multiples liées à une maladie rare ». Le formulaire comprend également des items en rapport avec les spécialistes qui devront intervenir durant la prise en charge et la durée prévisible des soins. La seconde pièce est le formulaire d’aide au remplissage, dans lequel le praticien décrit le tableau clinique (formule dentaire avec identification des agénésies dentaires, mais également des dents absentes pour d’autres étiologies), ainsi que les examens d’imagerie préconisés : orthopantomogramme, téléradiographie de profil, cliché rétro-alvéolaire, examen de type tomographie volumique à faisceau conique (CBCT), radiographie du poignet et de la main. Les principales étapes thérapeutiques sont également décrites dans ce formulaire, comme la simulation thérapeutique sur modèles d’étude, les soins conservateurs, prothétiques et chirurgicaux. Le plan de traitement implantaire en cours de croissance correspond systématiquement à la mise en place de 2 implants symphysaires. Le dernier élément du dossier de prise en charge correspond à un orthopantomogramme récent et de bonne qualité, ainsi qu’une radiographie du poignet et de la main, pour les patients proches de la fin de croissance, nécessitant une évaluation de la maturité squelettique.
II.3 Les oligodonties isolées
Les oligodonties isolées correspondent à une des indications phares des traitements implantaires précoces et sont définies par l’absence de pathologies extra-dentaires associées. Elles sont caractérisées par une faible prévalence, de l’ordre de 0,01%, beaucoup plus rares que les hypodonties (tableau clinique défini par un nombre d’agénésies entre 2 et 6) (Hagiwara et coll., 2015). Les tableaux cliniques sont variables, on trouve des agénésies préférentielles des incisives permanentes et des prémolaires dans le cadre des mutations des gènes MSX1-EDA, alors que les agénésies concernent les secteurs postérieurs dans les formes avec mutation du gène homéotique PAX9 (Fig 3 : tableau radiologique associé à une oligodontie isolée chez un patient âgé de 7 ans, Centre de Référence pour les Manifestations Bucco-dentaires des Maladies Rares de Strasbourg). Dans ce dernier cas de figure, l’indication de traitement implantaire est reportée à la fin de la croissance, les implants précoces en secteur postérieur étant contre-indiqués. Une autre forme très prévalente d’oligodontie non syndromique correspond aux mutations WNT10A, représentant sur le plan épidémiologique entre 30% et 50% des cas d’oligodontie (Plaisancié et coll., 2013 ; Arzoo et coll., 2014). Le tableau clinique correspond à une oligodontie sévère chez les individus homozygotes, avec des agénésies préférentielles au niveau de secteurs latéro-postérieurs et des incisives mandibulaires (Clauss et al., 2014) (Fig. 4 : tableau radiologique associée à une mutation WNT10A chez une patiente âgée de 8 ans, Centre de Référence pour les Manifestations Bucco-dentaires des Maladies Rares de Strasbourg). Toutefois, il existe une grande variabilité d’expression clinique des formes WNT10A, ce gène pouvant également être impliqué dans des formes syndromiques, comme le syndrome odonto-onycho-dermique ou le syndrome de Schöpf-Schulz-Passarge (Mégarbané et coll., 2004). Il apparaît fondamental de discuter le diagnostic différentiel entre une oligodontie isolée et syndromique, ce qui nécessite une consultation multi-disciplinaire au sein d’un centre de référence ou d’un service de génétique médicale.
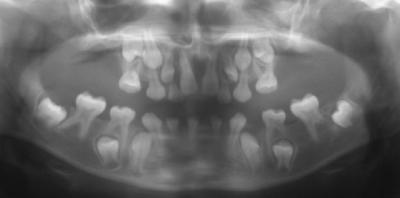
Fig 3 : tableau radiologique associé à une oligodontie isolée chez un patient âgé de 7 ans (Centre de Référence pour les Manifestations Bucco-dentaires des Maladies Rares de Strasbourg).
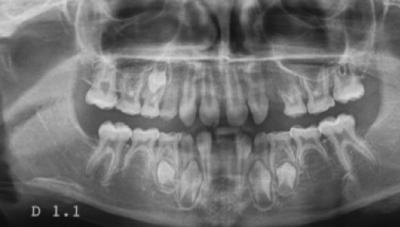
Fig 4 : tableau radiologique associé à une mutation WNT10A chez une patient âgée de 8 ans (Centre de Référence pour les Manifestations Bucco-dentaires des Maladies Rares de Strasbourg).
II.2 Les oligodonties syndromiques
Les oligodonties syndromiques correspondent à l’autre indication majeure des thérapeutiques implantaires précoces. Les dysplasies ectodermiques, liées à l’X ou autosomiques, constituent l’exemple le plus caractéristique, associant une oligodontie et des anomalies des autres dérivés ectodermiques comme les phanères, les glandes exocrines, la peau ou les épithéliums. Les principaux signes sont une oligodontie, des anomalies morphologiques dentaires, une dysmorphie faciale, des anomalies cutanéo-phanériennes et ophtalmologiques notamment (Clauss et coll., 2008). Face à un tableau clinique associant une oligodontie sévère, des anomalies dermatologiques à type d’eczéma, de sécheresse cutanée ou de cheveux clairsemés, le praticien se doit de coordonner une prise en charge diagnostique clinique et moléculaire dans un centre de Référence Maladies Rares ou d’adresser le patient pour une consultation de génétique médicale. Dans ce cadre, un conseil génétique sera mis en place, ainsi qu’une exploration moléculaire, biologique et par imagerie. Les gènes les plus fréquemment mutés dans les différentes formes de dysplasie ectodermique sont le gène EDA (forme liée à l’X), WNT10A (Forme autosomique récessive), EDAR ou EDARADD (formes autosomiques dominantes et récessives) (Cluzeau et coll., 2011). D’autres formes de dysplasie ectodermique sont caractérisées par la présence d’anomalies squelettiques, d’ostéopétrose, de fente labio-palatine, d’immunodéficience, de surdité ou de dégénérescence rétinienne, qui s’ajoutent aux anomalies ectodermiques (Brueggeman et coll., 2016).
De nombreux autres syndromes malformatifs intègrent une oligodontie dans leur spectre clinique et nécessitent un bilan diagnostique exhaustif avant de poser l’indication de thérapeutique implantaire précoce. Citons par exemple le syndrome de Rieger, les syndromes tricho-dento-osseux, tricho-rhino-phalangien ou les formes liées à une mutation LTBP3, ces dernières associant une oligodontie, une hyperdensité osseuse et des anomalies de structure amélaire (Noor et coll., 2009). Quelle que soit la forme syndromique, un bilan diagnostique médical, biologique, moléculaire et dento-maxillaire exhaustif est indiqué, avant de poser l’indication de thérapeutique implantaire. Bien sur, l’objectif thérapeutique premier de ces réhabilitations est de redonner le sourire à ces patients atteints d’oligodontie, cette affection ayant de multiples répercussions sur les plans esthétique et psycho-social (Fig. 5 : vue extra-orales d’un patient âgé de 5 ans présentant une dysplasie ectodermique avant et après insertion prothétique, Centre de Référence pour les Manifestations Bucco-dentaires des Maladies Rares de Strasbourg).
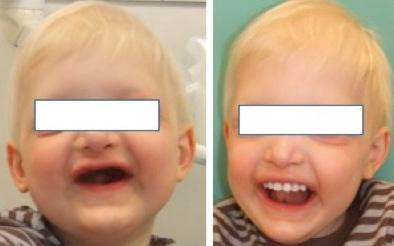
Fig 5 : Vue extra-orales d’un patient âgé de 5 ans présentant une dysplasie ectodermique avant et après insertion prothétique (Centre de Référence pour les Manifestations Buccodentaires des Maladies Rares de Strasbourg).
II.3 Présentation d’un patient âgé de 10 ans atteint de DEH autosomique récessive (mutation EDAR) avec mise en place de 2 implants symphysaires Nobel Biocare
Afin d’illustrer le tableau clinique et radiologique associé aux dysplasies ectodermiques et la prise en charge implantaire, nous présentons un patient âgé de 10 ans atteint d’une oligodontie sévère en rapport avec une dysplasie ectodermique autosomique (mutation EDAR). La prise en charge est coordonnée depuis l’âge de 5 ans au sein du centre de référence pour les manifestations dentaires des maladies rares de Strasbourg. Une instabilité prothétique au niveau mandibulaire, ainsi qu’une très bonne coopération nous ont mené à poser l’indication de mise en place de 2 implants symphysaires à l’état vigil. Les examens d’imagerie CBCT et les mesures effectuées en phase pré-opératoire ont montré une contexte osseux favorable, avec des dimensions osseuses symphysaires permettant l’utilisation d’implants standards Nobel Biocare de dimension 10 mm X 3,75 mm en situation para-médiane (Fig 6-7: vues per-opératoires de la mise en place et des 2 implants Nobel Biocare en situation para-médiane). Dans ce cas, le contexte anatomique osseux permet la mise en place d’implants standards et non pas de mini-implants, ce qui évite une phase chirurgicale de remplacement des mini-implants à la fin de la croissance squelettique.
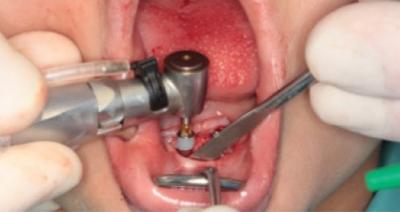
Fig 6 : vue per-opératoire de la mise en place des implants Nobel Biocare 3.75 X 10 mm (Centre de Référence pour les Manifestations Bucco-dentaires des Maladies Rares de Strasbourg).
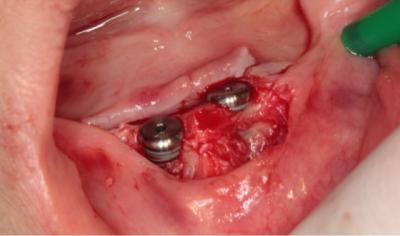
Fig 7 : vue per-opératoire des implants Nobel Biocare en situation para-médiane (Centre de Référence pour les Manifestations Bucco-dentaires des Maladies Rares de Strasbourg).
III) Contre-indications
Les principales contre-indications des thérapeutiques implantaires précoces sont liées au contexte pathologique, anatomique ou psychologique. En effet, si le bilan pré-opératoire montre une immaturité psychique, un défaut de coopération ou de compliance de la part du patient ou des parents, il est préférable de reporter la phase chirurgicale. Une implication et une bonne compréhension des différents aspects du traitement sont indispensables.
Dans certains cas d’anodontie avec hypotrophie osseuse marquée, le contexte anatomique étudié sur le bilan d’imagerie sectionnelle pré-implantaire (CBCT de préférence dans les contextes pédiatriques pour des raisons de radioprotection) ne permet pas la pose d’implants standards. Dans ce cas de figure, le praticien s’orientera soit vers la mise en place de mini-implants, soit vers un report de la thérapeutique implantaire, si les conditions anatomiques sont défavorables. En effet, si l’hypotrophie est très sévère avec un os péri-implantaire de faible volume, les risques chirurgicaux et de complications de l’ostéointégration implantaire sont trop importants.
Certaines formes d’oligodontie syndromique associées à une immunodéficience, une cardiopathie congénitale, une ostéopétrose ou des anomalies métaboliques contre-indiquent les traitements implantaires (Kawai et al., 2012). En effet, dans ces contextes syndromiques, les risque infectieux et chirurgicaux mènent à un rapport bénéfice/risque défavorable pour le patient, ainsi qu’à des risques de complications post-opératoires.
IV) Complications des traitements implantaires précoces
Une des complications des thérapeutiques implantaires précoces correspond à un enfouissement implantaire, mis en évidence par un suivi longitudinal post-opératoire de patients implantés en cours de croissance (Kearns et coll., 1999). Ce phénomène de submergence est lié à une croissance alvéolaire verticale des zones adjacentes et peut être traité par un geste chirurgical ou une adaptation du pilier supra-implantaire.
De plus, une étude a montré une plus forte prévalence de complications de l’ostéointégration avec perte d’implants et atteintes infectieuses péri-implantaires dans les cas de dysplasie ectodermique, comparés aux patients atteints d’oligodontie non syndromique (Bergendal et coll., 2008). Des modifications de l’axe implantaire liées à la croissance rotationnelle de la mandibule et aux variation de la direction de croissance faciale peuvent également être observées (Alcan et coll., 2006). Les types de croissance faciale, à rotation antérieure ou posérieure, correspondent respectivement à une typologie hypodivergente ou hyperdivergente, et doivent donc être identifiés en phase pré-opératoire. Un suivi longitudinal téléradiographique est indiqué, permettant de détecter un changement de la direction de croissance faciale, ce qui peut entraîner une modification de l’axe implantaire. Ce type de complication pourra être pris en charge par une modification du pilier supra-implantaire ou l’utilisation d’un pilier angulé.
Conclusions
Les indications des thérapeutiques implantaires correspondent à des contextes cliniques sévères et de faible prévalence. Elles doivent être posées au sein d’une équipe multi-disciplinaire. Les centres de référence maladies rares constituent un contexte idéal pour ce type de diagnostic et de prise en charge complexes. Les spécificités sont aussi bien d’ordre anatomique, en rapport avec l’hypotrophie osseuse et d’ordre physiologique, les processus de croissance mandibulaire et faciale devant être pris en compte. Les aspects psychologiques interviennent également, en rapport avec les répercussions psycho-sociales de ces anomalies du développement dentaire et à la nécessité d’une coopération optimale.
Remerciement
Les auteurs remercient la société Nobel Biocare pour son soutien au Centre de Référence pour les Manifestations Bucco-Dentaires des Maladies Rares de Strasbourg.
Bibliographie
Haute Autorité de Santé. Traitement des agénésies dentaires multiples liées aux dysplasies ectodermiques ou à d'autres maladies rares, 2006.
Bergendal B, Bjerklin K, Bergendal T, Koch G. Dental Implant Therapy for a Child with X-linked Hypohidrotic Ectodermal Dysplasia--Three Decades of Managed Care. Int J Prosthodont. 2015;28(4):348-56.
Alcan T, Basa S, Kargül B Growth analysis of a patient with ectodermal dysplasia treated with endosseous implants: 6-year follow-up. J Oral Rehabil. 2006;33(3):175-82.
Kramer FJ, Baethge C, Tschernitschek H. Implants in children with ectodermal dysplasia: a case report and literature review. Clin Oral Implants Res. 2007;18(1):140-6.
Aydinbelge M, Gumus HO, Sekerci AE, Demetoğlu U, Etoz OA. Implants in children with hypohidrotic ectodermal dysplasia: an alternative approach to esthetic management: case report and review of the literature. Pediatr Dent. 2013;35(5):441-6.
Kearns G, Sharma A, Perrott D, Schmidt B, Kaban L, Vargervik K. Placement of endosseous implants in children and adolescents with hereditary ectodermal dysplasia. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999;88(1):5-10.
Guckes AD, Scurria MS, King TS, McCarthy GR, Brahim JS. Prospective clinical trial of dental implants in persons with ectodermal dysplasia. J Prosthet Dent. 2002;88(1):21-5.
Kramer FJ, Baethge C, Tschernitschek H. Implants in children with ectodermal dysplasia: a case report and literature review. Clin Oral Implants Res. 2007;18(1):140-6.
Wang Y, He J, Decker AM, Hu JC, Zou D. Clinical outcomes of implant therapy in ectodermal dysplasia patients: a systematic review. Int J Oral Maxillofac Surg. 2016.
Hagiwara Y, Uehara T, Narita T, Tsutsumi H, Nakabayashi S, Araki M. Prevalence and distribution of anomalies of permanent dentition in 9584 Japanese high school students. Odontology. 2015 ; 26.
Plaisancié J, Bailleul-Forestier I, Gaston V et al. Mutations in WNT10A are frequently involved in oligodontia associated with minor signs of ectodermal dysplasia. Am J Med Genet A 2013: 161(4): 671-678.
Arzoo PS, Klar J, Bergendal B, Norderyd J, Dahl N. WNT10A mutations account for ¼ of population-based isolated oligodontia and show phenotypic correlations. Am J Med Genet A 2014: 164(2): 353-359.
Clauss F, Waltmann E, Barriere P, Hadj-Rabia S, Manière MC, Schmittbuhl M. Dento-maxillo-facial phenotype and implants-based oral rehabilitation in Ectodermal Dysplasia with WNT10A gene mutation: report of a case and literature review. J Craniomaxillofac Surg. 2014;42(6):346-51.
Mégarbané H, Haddad M, Delague V, Renoux J, Boehm N, Mégarbané A. Further delineation of the odonto-onycho-dermal dysplasia syndrome. Am J Med Genet A 2004: 129(2):193-197.
Clauss F, Manière MC, Obry F, Waltmann E, Hadj-Rabia S, Bodemer C, Alembik Y, Lesot H, Schmittbuhl M. Dento-craniofacial phenotypes and underlying molecular mechanisms in hypohidrotic ectodermal dysplasia (HED): a review. J Dent Res. 2008;87(12):1089-99.
Cluzeau C, Hadj-Rabia S, Jambou M, Mansour S, Guigue P, Masmoudi S, Bal E, Chassaing N, Vincent MC, Viot G, Clauss F, Manière MC, Toupenay S, Le Merrer M, Lyonnet S, Cormier-Daire V, Amiel J, Faivre L, de Prost Y, Munnich A, Bonnefont JP, Bodemer C, Smahi A. Only four genes (EDA1, EDAR, EDARADD, and WNT10A) account for 90% of hypohidrotic/anhidrotic ectodermal dysplasia cases. Hum Mutat. 2011 Jan;32(1):70-2.
Brueggemann FB, Bartsch O. A recurrent TP63 mutation causing EEC3 and Rapp-Hodgkin syndromes. Clin Dysmorphol. 2016;25(2):50-3.
Noor A, Windpassinger C, Vitcu I, Orlic M, Rafiq MA, Khalid M, Malik MN, Ayub M, Alman B, Vincent JB. Oligodontia is caused by mutation in LTBP3, the gene encoding latent TGF-beta binding protein 3. Am J Hum Genet. 2009;84(4):519-23.
Kawai T, Nishikomori R, Heike T. Diagnosis and treatment in anhidrotic ectodermal dysplasia with immunodeficiency. Allergol Int. 2012;61(2):207-17.
Bergendal B, Ekman A, Nilsson P. Implant failure in young children with ectodermal dysplasia: a retrospective evaluation of use and outcome of dental implant treatment in children in Sweden. Int J Oral Maxillofac Implants. 2008;23(3):520-4