Les bénéfices de l’utilisation combinée des allogreffes particulées (DFDBA) et des concentrés plaquettaires en chirurgie pré-implantaire.
 Comment l'utilisation combinée des allogreffes particulées et des concentrés plaquettaires facilitent la chirurgie pré-implantaire?
Comment l'utilisation combinée des allogreffes particulées et des concentrés plaquettaires facilitent la chirurgie pré-implantaire?
Parution LS 76, Spécial ADF 2017
Auteur : Pr Laurence Evrard MD DDS PhD
Service de dentisterie- chirurgie orale et maxillo-faciale- orthodontie et stomatologie
Hôpital Erasme- ULB- Bruxelles
Introduction
1. La résorption osseuse des maxillaires liée à la perte des dents
La résorption osseuse alvéolaire qui survient dans les suites d’une extraction dentaire est un phénomène physiologique, graduel, inévitable et irréversible. Selon les études, cette résorption mène à une perte de hauteur et d’épaisseur osseuse pouvant atteindre respectivement 40% et 60%. Le maximum de résorption survient endéans les trois mois à un an après l’extraction, avec les deux tiers dans les trois premiers mois (1, 2, 3).
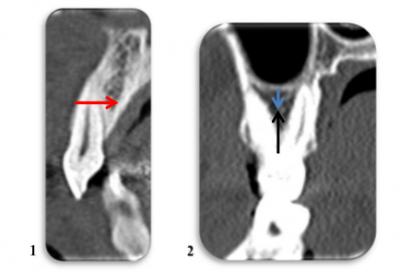
Dans la région des dents monoradiculées, la résorption se fait essentiellement dans le sens horizontal, tandis qu’au niveau des dents monoradiculées, elle prédomine de manière verticale (figure 1) (1, 2, 3).
Figures 1 et 2 : Dent monoradiculée (1) : résorption osseuse à prédominance horizontale. (flèche rouge) Au niveau des dents pluriradiculées (2), la résorption s’exerce principalement dans le sens vertical, tant par le niveau inférieur de l’os (flèche noire) que supérieur par la pneumatisation du sinus maxillaires qui résulte de la disparition du support radiculaire (flèche bleue).
Dans la partie postérieure du maxillaire, cette résorption osseuse s’accompagne d’une pneumatisation centrifuge des sinus maxillaires qui augmente avec l’âge (4). La résultante de ce phénomène est une réduction significative de la hauteur osseuse résiduelle sous-sinusienne, pouvant compromettre la pose d’implants dans ce secteur.
Dans une étude rétrospective chez 248 patients édentés, il a été observé que moins de la moitié des maxillaires des patients de plus de 65 ans disposent d’une hauteur osseuse supérieure ou égale à 6 mm (4).
La résorption post-extractionnelle peut aboutir à une situation de perte de volume osseux pouvant compromettre le plan de traitement implantaire. De plus, elle aboutit dans certains cas à une modification dans les rapports entre les crêtes osseuses de par la résorption qui se fait de manière centripète au maxillaire supérieur (figure 3), ce qui conduit à une situation défavorable sur le plan biomécanique et esthétique.
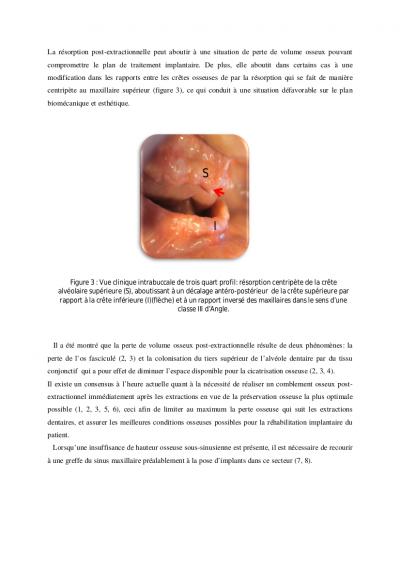
Figure 3 : Vue clinique intrabuccale de trois quart profil: résorption centripète de la crête alvéolaire supérieure (S), aboutissant à un décalage antéro-postérieur de la crête supérieure par rapport à la crête inférieure (I)(flèche) et à un rapport inversé des maxillaires dans le sens d’une classe III d’Angle.
Il a été montré que la perte de volume osseux post-extractionnelle résulte de deux phénomènes: la perte de l’os fasciculé (2, 3) et la colonisation du tiers supérieur de l’alvéole dentaire par du tissu conjonctif qui a pour effet de diminuer l’espace disponible pour la cicatrisation osseuse (2, 3, 4).
Il existe un consensus à l’heure actuelle quant à la nécessité de réaliser un comblement osseux post-extractionnel immédiatement après les extractions en vue de la préservation osseuse la plus optimale possible (1, 2, 3, 5, 6), ceci afin de limiter au maximum la perte osseuse qui suit les extractions dentaires, et assurer les meilleures conditions osseuses possibles pour la réhabilitation implantaire du patient.
Lorsqu’une insuffisance de hauteur osseuse sous-sinusienne est présente, il est nécessaire de recourir à une greffe du sinus maxillaire préalablement à la pose d’implants dans ce secteur (7, 8).
2. Techniques utilisées en chirurgie buccale pour éviter une perte de volume osseux post-extractionnel ou augmenter le volume osseux sous-sinusien
Les techniques d’aménagement alvéolaire et de greffe du sinus maxillaire se basent sur le comblement respectivement de l’alvéole vide ou de l’espace compris entre le plancher du sinus et la membrane de Schneider par du matériau biocompatible, avec ou sans adjuvant, avec ou sans membrane de couverture.
2.1. Biomatériaux utilisés en chirurgie buccale
On classe les biomatériaux utilisés en chirurgie buccale en deux catégories : les biomatériaux d’origine naturelle et les biomatériaux d’origine synthétique.
-
Les biomatériaux d'origine synthétique
Les biomatériaux d’origine synthétique sont le phosphate tricalcique, les hydroxyapatites, les céramiques biphasées, les verres bioactifs et les polymères (pour revue, voir 9, 10).
Les phosphates tricalciques (ßTCP) Ca3(PO4)2 sont produits en chauffant à plus de mille degrés et sous pression, un mélange de poudre de phosphate de calcium et de naphtalène qui, après sublimation, laisse une structure poreuse à l'origine des propriétés ostéoconductrices du matériau.
L’hydroxyapatite Ca10(PO4)6(OH)2 poreuse est obtenue par la transformation thermique du carbonate de calcium. Chimiquement, ce phosphate de calcium est le plus proche des cristaux d'apatites biologiques. Plusieurs porosités sont disponibles. Plus on choisira une porosité élevée, meilleure sera l'ostéoconduction.
Les Céramiques Biphasées (BCP) comportent une association d'hydroxyapatite et de phosphate tricalcique dans différentes proportions, ce qui permet de cumuler les qualités des deux matériaux notamment pour obtenir une résorption et des qualités mécaniques adéquates.
Les Bioverres, SiO2P2O5CaONaO, sont des matériaux appelés « bioactifs ». Cette « bioactivité » serait due à des réactions de surface du bioverre et à des échanges ioniques avec les fluides biologiques. La liaison os/verre biactif se ferait par l'intermédiaire d'une couche de gel de silice amorphe qui exercerait un effet chimiotactique sur les ostéoblastes. Les Polymères avec notamment le PMMA (polymethylmethacrylate), présentent une excellente biocompatibilité.
2. Les biomatériaux d'origine naturelle
Les biomatériaux d'origine naturelle sont l’os xénogène, le corail naturel et l’os allogène.
L'os xénogène (xénogreffe) est le plus souvent d'origine porcine ou bovine. L'os bovin anorganique conserve une structure spatiale osseuse lui conférant des propriétés ostéoconductrices. Ce sont des produits présentés sous forme lyophilisée (10, 11). Le corail naturel est composé à 99% de carbonate de calcium. Il conserve après traitement thermique une structure poreuse qui lui confère des propriétés ostéoinductrices (10, 11).
Les substituts osseux allogéniques sont produits à partir d'os de tête fémorale prélevée sur des individus humain (cadavre frais). Par rapport à l’os autogène, ils présentent l’avantage de ne pas nécessiter de prélèvement chez le patient (en effet, le prélèvement d’os autogène s’accompagne d’un risque accru de morbidité post-opératoire).
Il existe deux types d'allogreffe en fonction du traitement appliqué à l’os prélevé: l’allogreffe lyophilisée appellée Freeze Dried Bone Allograft (FDBA) et l’allogreffe lyophilisée déminéralisée appellée Demineralized Freeze Dried Bone Allograft (DFDBA) ou encore Demineralized Bone Matric (DBM).
Pour obtenir le FDBA, l'os prélevé va subir une série de traitements (12) : une élimination des tissus musculo-fibreux résiduels, une réduction de taille jusqu'à obtenir des particules de 5mm, une première décontamination, un traitement microbien à l'aide de solutions antibactériennes, antimycosiques et antifongiques, une congélation dans de l'azote liquide à -80°C, une déshydratation par lyophilisation, une deuxième réduction de la taille des particules, un conditionnement dans un emballage stérile, et enfin une stérilisation aux rayons gamma afin de diminuer le risque contamination. Le FDBA servira principalement de matrice pour la régénération osseuse: l'ostéoconduction.
Pour le DFDBA, la séquence de traitement est semblable mais avec une phase de déminéralisation dans un bain d'acide chlorhydrique qui se rajoute suite à la seconde réduction de taille des particules.
Le DFDBA possède des propriétés ostéoconductrices, c'est-à-dire qu’il sert d’échafaudage pour la colonisation du site receveur par différents types de cellules et de facteurs de croissance, et certains auteurs ont montré qu’il possède des propriétés ostéoinductrices c’est à dire qu’il permettrait la néoformation d’os. Ceci serait dû à la présence de Bone Morphogenetic Proteins (BMPs) au sein de la matrice osseuse (13, 14). En effet, en se résorbant, l’os libère les facteurs de croissance dont les BMPs appartenant à la superfamille des TGF β et isolées pour la première fois dans les années ‘60 par Marshal Urist, Chirurgien orthopédiste américain. Les BMP et notamment les isoformes 2, 3, 4 et 7 jouent un rôle crucial dans la cicatrisation osseuse en stimulant la différenciation des cellules souches mésenchymateuses en cellules osseuses (14).
L’habilité du DFDBA à être ostéoconduteur et ostéoinducteur serait influencée par différents facteurs comme l’âge du donneur (meilleure entre 41 et 50 ans pour un homme et 51 et 60 ans pour une femme), la taille des particules qui doit se situer entre 500 et 710 µm pour assurer un effet optimal), le taux de calcium résiduel ( l’ostéo-induction est optimale lorsque le pourcentage de calcium résiduel est de 2%) (15), ainsi que les méthodes de préparation, de stérilisation et de conservation (16). Il a été montré qu’il existe une grande variation dans les quantités de protéines extraites au sein de différents lots de DFDBA, et les auteurs ont émis l’hypothèse que des protéines puissent être dégradées au sein de certains lots DFDBA ou présentes en trop petite quantité au sein de la matrice osseuse donc indétectables avec leur méthode (14).
-
Adjuvants à la chirurgie : les concentrés plaquettaires autologues
Le but de l’utilisation des concentrés plaquettaires autologues (PRP et PRF) en chirurgie buccale et implantaire est d’accélérer et d’améliorer les phénomènes menant à la cicatrisation, et en particulier au cours des procédés chirurgicaux visant une régénération osseuse (pour revue, voir 17).
Le PRP (Platelet Rich Plasma), introduit par Marx et al. en 1998, est obtenu suite à deux centrifugations successives dans des tubes avec anticoagulant citrate dextrose A (évitant l’activation et la dégranulation plaquettaires). La gélification du concentré plaquettaire est obtenue de manière instantanée grâce à l’adjonction de thrombine bovine, de thrombine recombinante humaine ou de facteur tissulaire recombinant humain, ce qui déclenche l’activation des plaquettes et la polymérisation de la fibrine (18).
Des auteurs ont mis au point un protocole simplifié afin d’obtenir un concentré plaquettaire autologue sans utilisation d’anticoagulant ni de thrombine appelé PRF (Platelet-Rich-Fibrin) (19). Le sang veineux collecté sans ajout d’anticoagulant est immédiatement centrifugé pendant 10 à 12 minutes à 2700-3000 tours par minute. Les auteurs obtiennent 3 couches successivement du fond vers la surface du tube : les globules rouges, le caillot de PRF riche en plaquettes et en surface le plasma acellulaire riche en fibrine (figure 4).
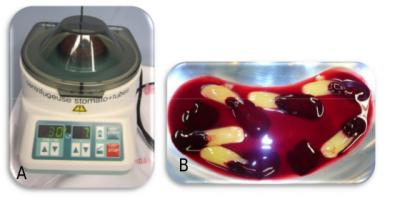
Figure 4: les tubes de sang prélevés chez le patient dans des tubes sans adjonction d’anticoagulant sont placés dans une centrifugeuse (A), et centrifugés à 3000t /min pendant 10 minutes. On obtient un matériel comportant une partie riche en fibrine (en jaune), et une partie riche en hématies (en rouge), entre lesquelles figure le caillot de PRF riche en plaquettes(B).
Le mécanisme naturel de la coagulation se déclenche lors de l’entrée en contact du sang avec la surface du tube en verre et permet l’obtention d’un caillot de fibrine riche en plaquettes et globules blancs, sans modifications biochimiques, c’est–à-dire sans ajout d’anticoagulant, de thrombine ou de chlorure de calcium. Le PRF peut être utilisé sous forme de gel ou de membranes.
Après centrifugation, la portion riche en plaquettes peut être mélangée au biomatériau (figure 5), tandis que la portion riche en fibrine peut être transformée en membrane par pression entre deux compresses (figure 6).
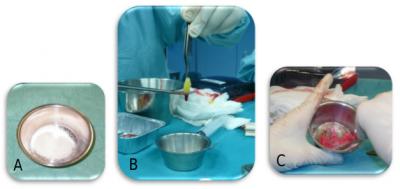
Figure 5 . A: os de banque (DFDBA) particulé 300-500 µm. B: la La portion riche en plaquettes se situe à la limite entre la partie riche en fibrine et la partie riche en hématies. Elle peut être coupée (B) et mélangée au DFDBA (C).
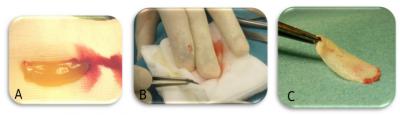
Figure 6 . La partie riche en fibrine (A) peut être pressée manuellement entre deux compresses (B) afin d’obtenir des membranes de fibrine autologues (C).
Le PRF présente l’avantage par rapport aux PRP d’être entièrement autologue et il a été montré qu’il libère les facteurs de croissances plaquettaires sur une période d'au moins une semaine (20), contrairement au PRP qui les libère endéans l’ heure qui suit sa péparation (21). Du fait de la facilité de son obtention, de son caractère purement autologue et du fait que la cascade de la coagulation s’effectue de manière physiologique sans adjonction de thrombine bovine, le PRF a tendance à remplacer actuellement le PRP.
Les concentrés plaquettaires contiennent du fibrinogène, des molécules d'adhésion cellulaire (fibrine, fibronectine et vitronectine) jouant un rôle dans la migration cellulaire et dans l'ostéoconduction, et aussi des facteurs de croissance tels que les PDGF (Platelet-Derived Growth Factor), TGF-β, EGF (Epithelial Growth Factor), IGF (Insuline-like Growth Factor) et VEGF (Vascular Endothelial Growth Factor) (20).
En chirurgie implantaire orale, les concentrés plaquettaires sont utilisés comme adjuvants aux procédures de reconstruction osseuse. Le but de leur utilisation est d’accélérer et d’améliorer les phénomènes menant à la cicatrisation, et en particulier à l’intégration des greffes osseuses et à la régénération osseuse (22).
On les utilise dans de nombreuses applications cliniques: le comblement du sinus maxillaire, les augmentations de crête osseuse alvéolaire, les reconstructions mandibulaires, le traitement des poches parodontales, le comblement des alvéoles dentaires post-extractionnelles, l’ostéointégration des implants dentaires (23, 24, 25, 26).
Des études ont pu montrer les effets bénéfiques des concentrés plaquettaires tels qu'une amélioration de la cicatrisation des tissus mous (27, 28). Cependant, l'amélioration de la régénération osseuse grâce à l'apport des concentrés plaquettaires est encore controversée (29, 30). Le manque de standardisation dans les protocoles d’obtention de ces concentrés plaquettaires peut expliquer le manque de concordance dans les différentes études, et de surcroît, la cinétique de délivrance des facteurs de croissance est un mécanisme encore mal connu, et qui peut montrer de grandes variations selon les patients et chez un même patient selon le moment de la journée au cours duquel le prélèvement sanguin a lieu ( il existe des variations circadiennes dans la concentration en plaquettes) (19, 20). Par ailleurs, les résultats contradictoires relevés dans la littérature au sujet des bénéfices apportés par l’utilisation des facteurs plaquettaires de la coagulation, peuvent en partie s’expliquer par le fait que ces résultats proviennent d’études cliniques pour certaines et d’études animales pour d’autres, et qu’il est difficile d’extrapoler les résultats obtenus d’une espèce à une autre (31, 32).
D’autre part, la concentration minimale en plaquettes nécessaire pour obtenir un caillot sanguin entrant dans les critères définissant le PRF n’est pas bien précisée par les auteurs. Ceux-ci s’accordent cependant sur le fait qu’un bénéfice clinique peut être obtenu pour une concentration de plaquettes de 1 million/µL de plasma (4 à 7 fois le taux de base) (33).
-
Utilisation d’une combinaison d’allogreffe et de concentrés plaquettaires
Les bénéfices liés à l’utilisation d’une combinaison de biomatériau tel que l’allogreffe et des concentrés plaquettaires sont encore controversés à l’heure actuelle.
Une étude (34) compare l’utilisation d’une allogreffe osseuse seule avec une allogreffe osseuse combinée au PRF pour le comblement du sinus maxillaire chez 9 patients. La combinaison allogreffe et PRF permettrait, selon les auteurs, d’obtenir une maturité osseuse plus rapidement, dès lors le placement des implants dentaires peut se faire à 4 mois post-opératoire par rapport à 8 mois pour le groupe contrôle.
Les bénéfices cliniques des concentrés plaquettaires combinés au DFDBA dans la régénération osseuses ont été montrés pour le traitement des poches parodontales (35, 36), mais n’ont encore jamais été évalués en chirurgie buccale dans une large cohorte de patients.
-
2.2. Techniques chirurgicales
-
Principes du comblement alvéolaire post-extractionnel
Les techniques de préservation alvéolaire post-extractionnelle se basent sur le principe de la régénération osseuse guidée. Le principe consiste à interposer une membrane entre les tissus mous et les contours osseux alvéolaires. Cette membrane empêche le passage et la prolifération des cellules épithéliales et du tissu conjonctif dans l’alvéole, permettant ainsi de garantir un espace qui pourra être colonisé par les cellules ostéoprogénitrices. Ceci prévient donc la croissance et l’invagination des tissus mous dans le site d’extraction durant la cicatrisation, permettant ainsi une préservation osseuse adéquate. Outre son rôle de maintien de l’espace, la membrane stabilise, protège et assure la contention du caillot sanguin et éventuellement du matériel de greffe qui a été inséré dans l’alvéole.
Le biomatériau placé dans l’alvéole dentaire sous la membrane de suite après l’extraction va constituer une structure dont l’architecture permettra de guider et soutenir la colonisation par les cellules ostéoprogénitrice et par là la régénération osseuse.
La technique du comblement alvéolaire à l’aide de DFDBA et de concentrés plaquettaires
La clinique d’Implantologie de l’Hôpital Erasme utilise en routine une combinaison d’os de banque de type DFDBA et de concentrés plaquettaires de type PRF sous forme de gel et de membrane lors des procédures d’aménagement alvéolaire post-extractionnel.
Au moment du début de la chirurgie, 6 à 8 tubes de sang de 10 ml sans anticoagulants sont prélevés chez le patient. La centrifugation à 3000t/min pendant 10 min ou 2800t/min pendant 12 minutes est effectuée, selon un protocole décrit dans une étude précédente (19). La partie riche en plaquettes (qui se trouve à la limite entre la partie jaune riche en fibrine et la partie rouge riche en hématies) est prélevée et mélangée avec de l’allogreffe (DFDBA) particulée d’une granulométrie de 300 à 500 µm. La partie riche en fibrine est pressée manuellement entre deux compresses afin d’obtenir des membranes de fibrine autologue. Des extractions atraumatiques sont réalisées, et immédiatement après, le comblement de l’alvéole est effectué à l’aide du mélange DFDBA-concentrés plaquettaires. La fermeture de l’alvéole est assurée par la membrane de fibrine, et des sutures résorbables (Vicryl® 3/0) sont effectuées (figure 7).
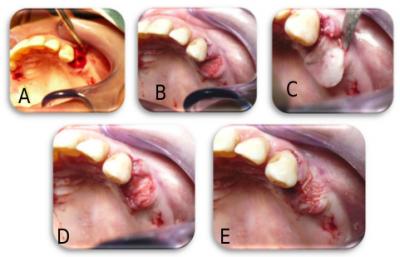
Figure 7 . Technique du comblement alvéolaire post-extractionnel tel que pratiqué au sein de la clinique d’Implantologie de l’hôpital Erasme. Immédiatement après extraction atraumatique (A), le comblement de l’alvéole est effectué à l’aide du mélange DFDBA et concentrés plaquettaires (B). La fermeture de l’alvéole a été assurée par la membrane de fibrine C, D), et des sutures résorbables (Vicryl® 3/0) (E).
Pendant la période post-opératoire, de l’ibuprofène 600 mg 3 fois par jour et du paracétamol 500 mg sont prescrits en cas de douleur. Tous les patients reçoivent 1 g d’amoxicilline deux fois par jour pendant quatre jours ou de la clindamycine 300mg trois fois par jour en cas d’allergie à la pénicilline, pendant quatre jours.
Cette technique donne de bons résultats en termes de conservation du volume osseux post-extractionnel (37).
2. La technique de la greffe du sinus maxillaire
Il existe différentes techniques d’augmentation du plancher sinusien pour recréer un volume osseux adéquat. Des études ont montré que les résultats de la greffe du sinus maxillaire en termes de taux de survie des implants qui y sont placés par la suite sont les meilleurs lorsque l’on utilise uniquement du biomatériau comme matériau de greffe du sinus maxillaire, avec 96.0% de survie des implants si on utilise 100% de biomatériau à 5 ans versus 87.8 % si on utilise de l’os autogène (37).
La technique que nous utilisons au sein de la clinique d’Implantologie de l’hôpital Erasme se base sur l’insertion sous la membrane de Scheider du sinus maxillaire, du mélange constitué exclusivement de DFDBA et de concentrés plaquettaires, après réalisation d’un volet osseux à la piézo-chirurgie au niveau de la paroi antéro-externe du sinus maxillaire. Des membranes de fibrine autologue seront placées au niveau des parois de la cavité, puis le mélange de DFDBA et concentrés plaquettaires autologues dont l’obtention est décrite au chapitre précédent est placé dans la cavité. Des membranes de fibrine autologues sont alors appliquées à l’extérieur de la greffe, puis le lambeau mucopériosté est suturé en place (figure 8).
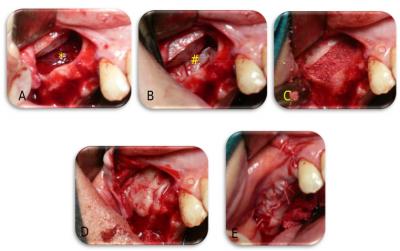
Figure 8 . Procédure de la greffe de sinus maxillaire telle que réalisée au sein de la clinique d’implantologie de l’hôpital Erasme. Un volet osseux est réalisé à la piézo-chirurgie au niveau de la paroi antéro-externe du sinus maxillaire droit , suivi de la bascule horizontale de celui-ci tout en soulevant la membrane de Schneider (*) du sinus (A). Des membranes de fibrine autologues (#) sont placées au niveau des parois interne, antérieure et postérieure de la cavité (B), puis le mélange de DFDBA et concentrés plaquettaires autologues est placé dans la cavité (C). Des membranes de fibrine autologues sont alors appliquées à l’extérieur de la greffe (D), puis le lambeau mucopériosté est suturé en place (E).
2. Cas clinique
Un patient de 57 ans se présente à notre consultation pour un bilan pré-implantaire.
Il est en bonne santé, ne prend pas de médicament, ne fume pas et ne boit pas d’alcool.
Le bilan clinique et radiologique (figure 9) réalisés aboutit à l’indication de l’extraction des dents 14, 23, 24, 25, 26 et à un assainissement parodontal. Huit semaines après les extractions, des greffes du sinus maxillaire gauche et à droite sont planifiées, qui seront suivies du placement de sept implants au maxillaire supérieur six mois plus tard.
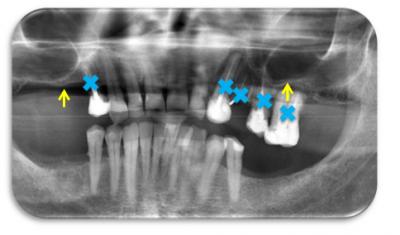
Figure 9 . Radiographie panoramique d’un patient de 57 ans dont les des dents 14, 23, 24, 25, 26 (croix) sont porteuses de caries et d’infections apicales et sont à extraire. On constate une faible hauteur osseuse sous-sinusienne à gauche et à droite (flèche).
Les extractions sont réalisées en hôpital de jour sous anesthésie locale et sont suivies immédiatement d’un comblement alvéolaire à l’aide de DFDBA 300-500 µm mélangé aux concentrés plaquettaires autologues.
Six semaines après les extractions, un bilan dental scanner est réalisé, qui permet de vérifier que la muqueuse sinusienne est exempte de pathologie et qu’il existe une bonne perméabilité de la voie de drainage des sinus maxillaires. Les greffes des sinus maxillaires sont réalisées sous anesthésie générale huit semaines après les extractions.
Six mois après les greffes des sinus, un bilan pré-implantaire par imagerie dental scanner est effectué. Ce bilan radiologique permet de constater le maintien de volume osseux grâce à l’application de la technique de comblement alvéolaire (figure 10), offrant la possibilité de poser des implants dans un axe favorable dans les régions antérieures (figure 10) et postérieures (figure 11) des maxillaires.
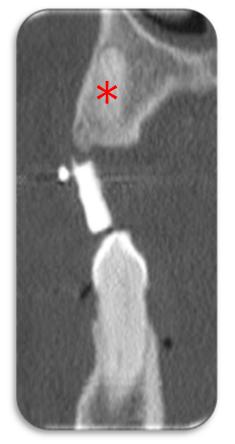
Figure 10. Dental Scanner pré-implantaire. On distingue
Les contours de l’alvéole dentaire de la 23 marquée d’une étoile.
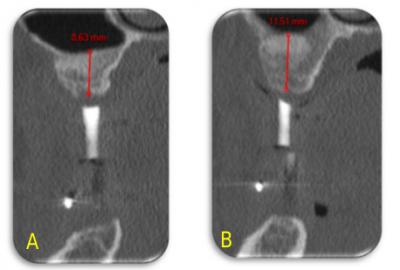
Figure 11. Dental scanner pré-implantaire réalisé six mois après la greffe de sinus. Au niveau du site de la dent 16 (A), la hauteur osseuse sous-sinusienne est de 8,63 mm, et au niveau de la dent 26 (B), elle est de 11,51 mm, ce qui autorise la pose d’implants.
Six mois après les greffes de sinus, les implants sont posés en 16, 15, 14, 23, 24, 25, 26, 36 et 46 (figure 12).
Figure 12. Radiographie panoramique permettant de visualiser les implants posés au niveau des sites dentaires 16, 15, 14, 23, 24, 25, 36 et 46.
Cinq mois après leur pose et au terme de la période d’ostéointégration des implants, les prothèses dentaires sont réalisées (figure 13).
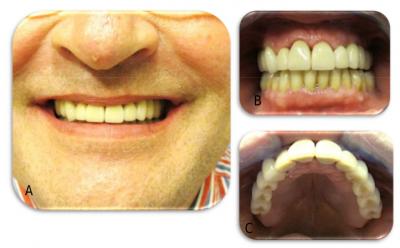
Figure 13 . Cinq mois après la pose des implants, les prothèses sont réalisées. A, B: vues cliniques de face. C: vue clinique des émergences des vis prothétiques que l’on distingue au niveau des dents 16, 15, 14, 23, 24, 25 et 26, celles-ci se trouvent dans l’axe prothétique idéal (au centre de la table occlusale).
Conclusion
L’utilisation combinée du DFDBA 300-500 µm et des concentrés plaquettaires autologues type PRF pour l’aménagement alvéolaire post-extractionnel et le sinus lift donne des résultats cliniques prédictibles.
Bibliographie
-
Araújo MG, Lindhe J. et al. Socket grafting with the use of autologous bone: an experimental study in the dog. Clin Oral Implants Res. 2011 Jan;22(1):9-13.
-
Van der Weijden F, Dell'Acqua F et al. Alveolar bone dimensional changes of post-extraction sockets in humans: a systematic review. J Clin Periodontol. 2009 Dec;36(12):1048-58.
-
Covani U, Ricci M, Bozzolo G, Mangano F, Zini A, Barone A. Analysis of the pattern of the alveolar ridge remodeling following single tooth extraction. Clin Oral Implants Res. 2011; 22(8):820-25.
-
Oikarinen K, Raustia AM, Hartikainen M. General and local contraindications for endosseal implants--an epidemiological panoramic radiograph study in 65-year-old subjects.Community Dent Oral Epidemiol. 1995 Apr;23(2):114-8.
-
Vignoletti F, Matesanz P et al. Surgical protocols for ridge preservation after tooth extraction A systematic review. Clin Oral Implants Res. 2012 Feb;23 Suppl 5:22-38.
-
Ten Heggeler JM, Slot DE et al. Effect of socket preservation therapies following tooth extraction in non-molar regions in humans: a systematic review. Clin Oral Implants Res. 2011 Aug;22(8):779-88.
-
Van den Bergh JPA, ten Bruggenkate CM, Krekeler G, Tuinzing DB. Maxillary sinus floor elevation and grafting with human demineralized freeze dried bone. Clin Oral Impl Res 2000; 11:487-493.
-
Mazor Z, Peleg M, Gross M. Sinus augmentation for single tooth replacement in the posterior maxilla: A 3-year follow-up. Int J Oral Maxillofac Implants 1999; 14:55-60.
-
Bader H. et al. Immediate extraction site grafting: materials and clinical objectives. Dent Today. 2005 Jul;24(7):86-9.
-
Bader H. et al. Immediate extraction site grafting: materials and clinical objectives. Dent Today. 2005 Jul;24(7):86-9.
-
Tischler M, Misch CE et al. Extraction site bone grafting in general dentistry. Review of applications and principles. Dent Today. 2004 May;23(5):108-13.
-
Holtzclaw D, Toscano N, Eisenlohr L, Callan D. The safety of bone allografts used in dentistry: a review.J Am Dent Assoc. 2008 Sep;139(9):1192-9. Review.
-
Zhang M, Powers RM, Wolfinbarger L Jr. Effects of the demineralization process on the osteoinductivity of demineralized bone matrix. J Periodontol. 1997; 68: 1085-1092.
-
Li H., Pujic Z., Xiao Y., Bartold PM. Identification of Bone Morphogenetic Proteins 2 and 4 in Commercial De mineralized Freeze-dried bone Allograft Preparations: Pilot study. Clin Implant Res Dent Rel Res 2000; 2(2): 110-117.
-
Ghanbari H., Moeintaghavi A., Sargolzaei N., Foroozanfar A., Dadpour Y. Comparative study of Algipore and Decalcified Freeze-Dried Bone Allograft in open maxillary sinus elevation using piezoelectric surgery. J Periodontol Implant Dent 2013; 5(1): 1-6.
-
Schwartz Z, Mellonig JT, Carnes DL, De la fontaine J, Cochran D.L, Dean B.B, Boyan B.D. Ability of commercial demineralized freeze-dried bone allografts. J Periodontol 1996 ; 67 :918-926.
-
Bayens M, Glineur R, Evrard L. L’intérêt de l’utilisation des facteurs plaquettaires de la coagulation : Platelet-Rich Plasma (PRP) et Platelet-Rich Fibrin (PRF) dans la reconstruction osseuse pré-implantaire. Rev Med Brux 2010; 31 :521-7.
-
Marx RE, Carlson ER, Eichstaedt RM, Schimmele SR, Strauss JE, Georgeff KR.
Platelet-rich plasma: Growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998 ; 85: 638-46.
-
Dohan DM, Choukroun J, Diss A, Dohan SL, Dohan AJ, Mouhyi J, Gogly B. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part I: technological concepts and evolution. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006 ; 101 : 37-44.
-
Dohan DM, Choukroun J, Diss A, Dohan SL, Dohan AJ, Mouhyi J, Gogly B. Platelet-rich fibrin (PRF): a second-generation platelet concentrate. Part II: platelet-related biologic features. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006 ; 101 : 45-50.
-
Hallman M, Thor A. Bone substitutes and growth factors as an alternative/complement to autogenous bone for grafting in implant dentistry. Periodontol 2000. 2008 ; 47 : 172-92. Review.
-
Marx RE, Garg AK. Dental and craniofacial applications of platelet-rich plasma. Quintessence Publishing Co, Inc. 2005.
-
Steigmann M, Garg AK. A comparative study of bilateral sinus lifts performed with platelet-rich plasma alone versus alloplastic graft material reconstituted with blood. Implant Dent. 2005 ; 14 : 261-6.
-
Ito K, Yamada Y, Naiki T, Ueda M. Simultaneous implant placement and bone regeneration around dental implants using tissue-engineered bone with fibrin glue, mesenchymal stem cells and platelet-rich plasma. Clin Oral Implants Res. 2006;17 : 579-86.
-
Hanna R, Trejo PM, Weltman RL. Treatment of intrabony defects with bovine-derived xenograft alone and in combination with platelet-rich plasma: a randomized clinical trial. J Periodontol. 2004 ; 75 : 1668-77.
-
Anitua E, Orive G, Aguirre JJ, Andía I. Clinical outcome of immediately loaded dental implants bioactivated with plasma rich in growth factors: a 5-year retrospective study. J Periodontol. 2008 ; 79 : 1168-76.
-
Choukroun J, Diss A et al. Platelet-rich fibrin (PRF): a second-generation platelet concentrate Part IV: clinical effects on tissue healing. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006 Mar;101(3):e56-60.
-
Hom DB, Linzie BM, Huang TC. The healing effects of autologous platelet gel on acute human skin wounds.Arch Facial Plast Surg. 2007 May-Jun;9(3):174-83.
-
Piemontese M, Aspriello SD, Rubini C, Ferrante L, Procaccini M. Treatment of periodontal intrabonydefects with demineralized freeze-dried bone allograft in combination with platelet-rich plasma: a comparative clinical trial. J Periodontol. 2008 May; 79(5): 802-10.
-
Singh A,Kohli M, Gupta N. Platelet Rich Fibrin: A Novel Approach for Osseous Regeneration. J. Maxillofac. Oral Surg. 2012 Dec; 11(4):430-4.
-
Casati MZ, de Vasconcelos Gurgel BC, Gonçalves PF, Pimentel SP, da Rocha Nogueira Filho G, Nociti FH Jr, Sallum EA. Platelet-rich plasma does not improve bone regeneration around peri-implant bone defects--a pilot study in dogs. Int J Oral Maxillofac Surg. 2007 ; 36 : 132-6.
-
Gürbüzer B, Pikdöken L, Urhan M, Süer BT, Narin Y. Scintigraphic evaluation of early osteoblastic activity in extraction sockets treated with platelet-rich plasma. J Oral Maxillofac Surg. 2008 ; 66 : 2454-60.
-
Weibrich G, Hansen T, Kleis W, Buch R, Hitzler WE. Effect of platelet concentration in platelet-rich plasma on peri-implant bone regeneration. Bone. 2004 ;34 : 665-71.
-
Choukroun J, Diss A, Simonpieri A, Girard MO, Schoeffler C, Dohan SL, Dohan AJ, Mouhyi J, Dohan DM. Platelet-rich fibrin (PRF): a second-generation plateletconcentrate. Part V: histologic evaluations of PRF effects on bone allograft maturation in sinus lift. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2006 ; 101 : 299-303.
-
Bansal C, Bharti V. Evaluation of efficacy of autologous platelet-rich fibrin with demineralized-freeze dried bone allograft in the treatment of periodontal intrabony defects. J Indian Soc Periodontol. 2013 ;17(3):361-6.
-
Markou N, Pepelassi E, Kotsovilis S, et al.The use of platelet-rich plasma combined with demineralized freeze-dried bone allograft in the treatment of periodontal endosseous defects: a report of two clinical cases. J Am Dent Assoc. 2010 ;141(8):967-78.
-
Baniasadi B, Evrard L. Alveolar Ridge Preservation after Tooth Extraction with DFDBA and Platelet Concentrates: a Radiographic Retrospective Study. Open Dent J, 2017, 14: 99-108.