Advanced Platelet Rich FibrinTM ou A-PRFTM : Un nouveau « Gold Standard » dans les concentrés sanguins ?
texte
Les concentrés plaquettaires sont utilisés de façon routinière depuis de nombreuses années dans plusieurs spécialités chirurgicales ou médicales. Le principe est de récupérer les cytokines ou facteurs de croissance contenus dans les plaquettes sanguines ou Thrombocytes après la centrifugation du sang total. Plusieurs protocoles ont été proposés selon le type de centrifugation et le type de tubes : PRP, PRGF et PRF.
La technique du PRF a mis plusieurs années à s’imposer et elle est aujourd’hui considérée comme la plus simple, la moins onéreuse et la plus efficace. Les résultats cliniques du PRF sont principalement liés à la libération prolongée des facteurs de croissance mais aussi à la présence de la fibrine polymérisée obtenue à la fin de la centrifugation.
Cependant, les récentes avancées en biologie cellulaire vont nous permettre de proposer une amélioration des propriétés de ces concentrés « sanguins » autologues en utilisant les propriétés de certaines cellules sanguines. L’impact ou le rôle des cellules blanches présentes dans le sang, jusqu’à présent complètement négligé, va peut-être devenir prépondérant grâce à la découverte du rôle fondamental joué par ces cellules et en particulier les Monocytes dans la néo-angiogenèse et la croissance osseuse.
L’interdiction par l’ANSM des anciens tubes pour le PRF car non conformes à règlementation des dispositifs médicaux nous a conduits à concevoir un nouveau tube en même temps qu’un nouveau protocole a été élaboré.
A. Le PRF ou Platelet Rich Fibrin™
A la fin du siècle dernier, les travaux de Marx [1] mettent en lumière la possibilité de récupérer des cytokines ou facteurs de croissance en concentrant le sang autologue par centrifugation. C’est la naissance du PRP ou Platelet Rich Plasma. L’accent est mis sur les facteurs libérés par les plaquettes sanguines ou Thrombocytes. En 2001, la technique du PRF ou Platelet Rich Fibrin est décrite [2], avec comme différence, la possibilité de concentrer les plaquettes dans un caillot de fibrine, en supprimant les anticoagulants. La centrifugation sans anticoagulants permet de récupérer le caillot de fibrine qui renferme les plaquettes et donc ses facteurs de croissance que sont entre autres, le PDGF, les TGF Beta et le VEGF. La fibrine jouant un double rôle : réservoir de cytokines et matrice de cicatrisation cellulaire.

Image 1. Le caillot de fibrine PRF et l’utilisation de la PRF « Box »
Ce réservoir constitué par la fibrine (fibrinogène coagulé) va permettre une libération prolongée de facteurs de croissance, décrite dans plusieurs articles scientifiques [3]. Cette libération prolongée permet d’obtenir un effet plus puissant dans la mesure où les cytokines libérées lentement stimulent de manière plus importante les cellules avoisinantes. A l’image d’une perfusion continue. C’est là une des propriétés les plus intéressantes du PRF. Mais le PRF apporte aussi de la fibrine qui joue le rôle de matrice cellulaire, c.a.d. un composant qui se remplit de cellules et qui va donner naissance à un nouveau tissu. Car la fibrine ne se résorbe pas, elle se transforme.. Ainsi, de nombreuses indications ont pu être décrites comme l’utilisation dans les greffes osseuses, les sinus lifts, les comblements d’alvéole ou la stimulation de la cicatrisation gingivale. [4] [5] [6] A ce jour, plus de 180 articles internationaux ont été publiés sur le PRF, dont 52 depuis le début de l’année 2013.
B. Le rôle des cellules blanches et des monocytes
Les leucocytes peuvent être divisés en deux grandes catégories : les granulocytes et les agranulocytes.
1. Granulocytes: éosinophiles, neutrophiles et basophiles.
•Les éosinophiles sont conçus pour attaquer les parasites et ils jouent également un rôle dans les réactions allergiques.
•Les neutrophiles, eux, attaquent les bactéries et les champignons
•Tandis que les basophiles jouent un rôle dans l’activité immunitaire.
Chez une personne ayant un niveau normal de leucocytes, environ 50 à 60 % sont des neutrophiles, composés de 1 à 4 % d’éosinophiles et moins de 2 % de basophiles.
2. Agranulocytes : monocytes et lymphocytes
• Les lymphocytes représentent environ 20-40% du nombre total de leucocytes. Les lymphocytes comprennent les lymphocytes B, les lymphocytes T ainsi que des cellules tueuses naturelles, faisant tous partie du système immunitaire.
•Les monocytes constituent 2 à 9 % de la numération des globules blancs. Ils sont conçus pour offrir des antigènes aux lymphocytes afin de stimuler les réponses immunitaires. Ces cellules finissent alors par se transformer en macrophages. Ces cellules jouent un rôle majeur dans les phénomènes inflammatoires qui sont les premiers pas de la cicatrisation.
Dans les différentes techniques de concentrés plaquettaires, il ressort que le taux de cellules blanches est différent. Dans les PRP, il varie de 0 à 50% et dans le PRF, il est relativement fixe : au-dessus de 50%
Dès 2002, de nombreux auteurs ont décrit la possibilité par les cellules blanches de libérer des facteurs de croissance comme le VEGF ou le PDGF. Weibrich [7] Dohan [8]
3. Incidence des Monocytes
Jusqu’en 2010, le rôle de chaque type de lignée de cellules blanches dans les concentrés plaquettaires n’est pas précisé, puisque leur spécificité n’est pas encore tout à fait définie. A partir de 2011, le rôle des cellules blanches commence à être décrit. DAVIS [9] insiste sur les effets stimulants des métallo-protéinases libérées par les cellules blanches, avec comme corollaire une meilleure et plus rapide néo angiogenèse.
Omar et Thomsen [10] vont démontrer que les monocytes sont les premiers à envoyer des signaux positifs pour la stimulation des cellules progénétrices osseuses. Cet effet est capital, car il va immédiatement déclencher une cascade de réactions qui vont aboutir à l’ostéogénèse.
Peu après, la découverte de récepteurs aux BMP dans les monocytes va aller dans ce sens [11] : les monocytes sont sensibles, via des récepteurs spécifiques, à ces protéines puissantes que sont les BMP et qui sont capables non seulement de stimuler l’ostéogénèse mais aussi de nombreuse autres réactions comme la croissance d’organes etc. Vicky [12] va démontrer comment les monocytes vont induire la différenciation des cellules mésenchymateuses en ostéoblastes fonctionnels permettant la production rapide d’os nouveau.
Il devient alors évident que la présence des monocytes devient un objectif prioritaire, si l’on veut accroitre la stimulation osseuse par le PRF. En biologie, il n’est pas rare que lorsqu’une cellule possède des récepteurs à une molécule, elle peut aussi synthétiser la même molécule ou une substance équivalente. Nous allons immédiatement nous diriger vers cette hypothèse pour tenter de récupérer des BMP synthétisées et libérées par les Monocytes. Pirraco [13], viendra confirmer il y a peu, cette théorie en démontrant la production de BMP par les monocytes et les macrophages.
C. Les monocytes et le PRF
L’analyse histologique des caillots de PRF a permis de faire une constatation surprenante : les monocytes sont à la frontière du caillot de fibrine et des globules rouges. En effet, on ne retrouve que peu de monocytes dans la fibrine. Cela est vraisemblablement dû à la vitesse de centrifugation qui pousse ces cellules blanches, les plus grosses, vers l’extrémité du caillot.
Nous avons alors entrepris une série de tests, réduisant progressivement la vitesse de centrifugation pour arriver finalement à la meilleure vitesse qui est 1500 tours/mn Dans cette configuration, la totalité des monocytes se retrouvent également répartis dans le caillot de fibrine, mais nous obtenons également une meilleure répartition des plaquettes sanguines, qui à l’origine, étaient concentrées également dans l’extrémité inférieure du caillot.

IMAGE 2 Monocytes dans le PRF et le A-PRF
Mais nous avons également tenu compte du temps nécessaire pour obtenir l’activation de certains monocytes en macrophages. Il fallait également allonger le temps de coagulation dans le tube, ce qui a été obtenu grâce à l’utilisation d’un composite en verre spécial qui a permis de ralentir la formation du caillot. Ce nouveau protocole portera le nom de Advanced PRF™ ou A-PRF™
D. Les nouveaux tubes A-PRF 10 et la réglementation européennes
L’ANSM nous notifie dès le mois de juin 2012, l’interdiction d’utiliser des tubes qui sont des DM-DIV (dispositifs médicaux de diagnostic in vitro, réservés à l’usage des laboratoires pour les analyses sanguines) et donc non homologués pour la récupération des concentrés plaquettaires appliqué en thérapeutique humaine. Ceci nous oblige donc à produire des DM (Dispositifs Médicaux), certifiés selon la directive CE 93/42. La conception du nouveau protocole et du nouveau tube vont donc aller de pair : utiliser des tubes règlementaires et inclure la totalité des monocytes dans le caillot de fibrine final.
Les nouveaux tubes ont été fabriqués selon notre cahier des charges et ont été certifiés comme dispositifs médicaux (DM) selon la directive européenne CE 93/42. La paroi est un composite spécial à base de verre. Ils sont conditionnés dans un emballage stérile individuel. La durée de validité du tube est de 2 ans à compter de la date de stérilisation. Ils portent le nom de A-PRF 10.
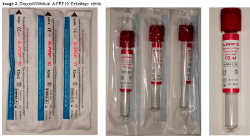
IMAGE 3 Tube A-PRF 10
E. Les résultats
1. Dosage des cytokines
Les tests biologiques ont été réalisés aux USA (Clarion Research Lab, Clarion university, Pennsylvanie) et en Allemagne (Repair Lab, Johannes Gutenberg university, MAINZ). Ces résultats seront publiés très prochainement. Il a été effectué également une comparaison de la libération des cytokines entre le PRP, le PRF et le A-PRF, ainsi que l’analyse comparée de la néo vascularisation obtenue avec le PRF et le A-PRF.
Les résultats vont confirmer notre hypothèse cellulaire : le A-PRF libère toutes les cytokines déjà présentes dans le PRF mais le VEGF est libéré en plus grande quantité par le A-PRF (significatif) mais nous avons trouvé également des BMP 2, et 7. La surprise a été de retrouver des BMP dans l’exsudat : 50% des BMP immédiatement disponibles sont dans l’exsudat récolté dans la PRF Box.

Image 4 dosage cytokines et BMP dans le PRF et A-PRF.
2. Protocole d’analyse clinique : Les premières études cliniques ont porté sur la cicatrisation des sites d’extraction. C’est le moyen le plus simple pour mettre en évidence le type de cicatrisation et de pouvoir la comparer avec celle du PRF, avant de passer à l’étude histologique de la gencive et de l’os obtenu.
Le A-PRF est évidemment utilisé comme seul biomatériau de comblement afin d’évaluer simplement le potentiel du nouveau concentré sanguin.
Pour le PRF, la cicatrisation des tissus mous est accélérée avec le PRF mais lorsque le PRF est exposé, il est rapidement recouvert par une couche de cellules épithéliales et s’ensuit une épithélialisation progressive.
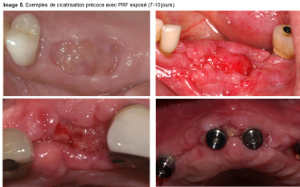
Image 5 : cicatrisation de l’alvéole avec le PRF exposé.
Avec le A-PRF, la cicatrisation est réellement différente : plus rapide, avec une croissance propre des lambeaux tout à fait originale.
Cicatrisation gingivale et osseuse. Images 6,7,8,9,10,11,12,13 et 14
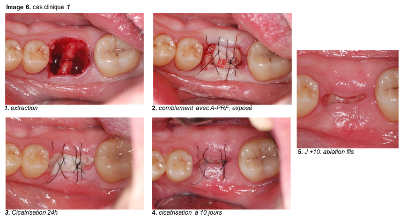
Image 6
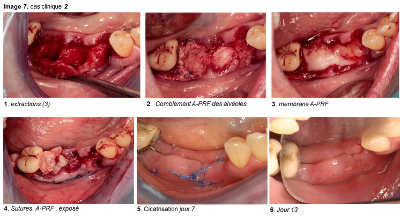
Image 7
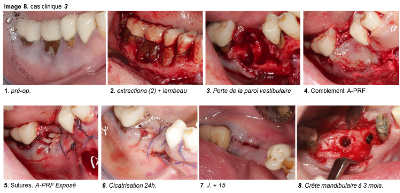
image 8
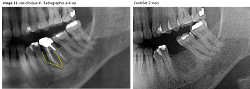
Image 9

Image 10
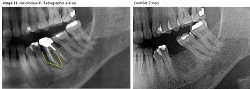
Image 11
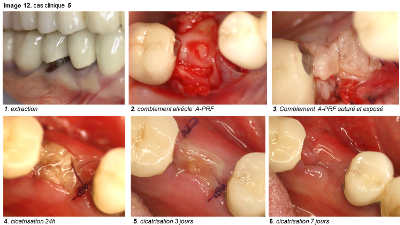
Image 12
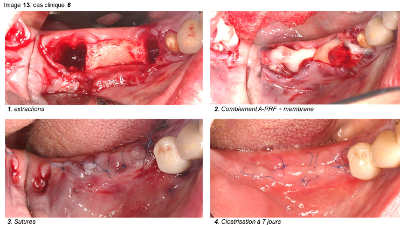
Image 13
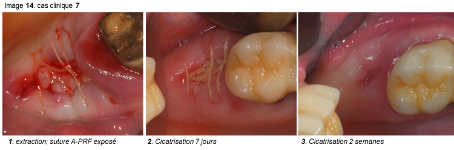
Image 14
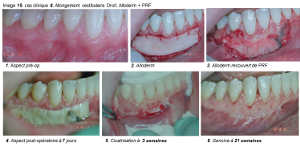
Image 15
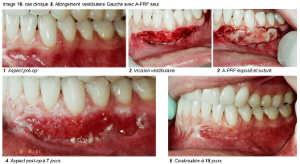
Image 16
Résultats : Nos résultats sont en total accord avec ceux de Kamazoe , qui a amélioré sensiblement les résultats du PRP en rajoutant des leucocytes [14].
a. Cicatrisation gingivale : Dans tous les cas cliniques que nous avons réalisés, nous sommes immédiatement surpris par la rapidité de la croissance gingivale précoce. Au lieu de voir le PRF se recouvrir progressivement par un nouvel épithélium, c’est tout le lambeau qui progresse, en entier, pour recouvrir la fibrine exposée. D’ailleurs, on voit bien les points de suture se détendre au fil des jours, prouvant la progression des deux berges gingivales.
Le bourgeonnement des bords gingivaux est très rapide, avec volume gingival remarquable. Il en est de même pour la gencive kératinisée.
Tous les cas cliniques réalisés selon le même protocole, ont cicatrisé de la même manière et différemment du PRF classique. La présence de monocytes influe manifestement sur les premiers jours de la cicatrisation.
b. Cicatrisation osseuse : Dans les cas cliniques que nous présentons, les parois osseuses ne sont pas toujours présentes. Le comblement est réalisé uniquement avec du A-PRF. La croissance osseuse dans ces alvéoles est très rapide et permet de maintenir le volume de la crête osseuse malgré l’absence de paroi vestibulaire. Il est classique de ne pas avoir de reconstruction complète de la crête vestibulaire lorsqu’une paroi osseuse est défaillante. Dans ces deux cas cliniques, la reconstruction est parfaite malgré l’absence de mur vestibulaire. Pour l’instant, nous ne pouvons pas avancer d’hypothèse précise à l’origine de ce phénomène : Sont-ce les BMP dans le caillot qui en sont responsables ou bien la couverture de la zone par la gencive ou les deux ? D’autres études, plus approfondies, seront nécessaires pour essayer d’expliquer ce phénomène surprenant et intéressant.
F. Les nouvelles pistes de recherche en ingénierie cellulaire
Avoir approché de près les mécanismes cellulaires nous a permis d’approcher de près les « CCN proteins», protéines impliquées dans les communications cellulaires intimes. On savait que les cellules communiquaient entre elles afin d’organiser au mieux les processus de réparation ou de cicatrisation. Ces communications sont gérées par le « CCN protein » Ces protéines sont au nombre de 6. Les fonctions de ces protéines est aussi d’organiser la matrice extracellulaire si précieuse pour la croissance vasculaire. Or il ressort, selon des travaux très récents, que les fonctions biologiques de ces CCN sont fortement dépendantes du microenvironnement et du moment où elles s’y trouvent. [15]. Les proteines « CCN » sont produites en partie par les plaquettes sanguines et participent au contrôle de la prolifération cellulaire, l’adhésion et la migration des cellules. Il devient évident que nous devons aller vers plus de connaissances sur les relations entre les cytokines, les BMP et les « CCN », si nous voulons continuer à améliorer les propriétés des concentrés sanguins dans tous les processus de cicatrisation tissulaires et osseux.
Conclusion
La mise en application des principes biologiques physiologiques reste la voie la plus efficace pour améliorer les processus inflammatoires et la cicatrisation. La présence de monocytes permet une cicatrisation plus rapide avec une reconstitution d’un tissu gingival d’excellente qualité et d’épaisseur surprenante. La fermeture rapide de la plaie et la présence de fibrine enrichie dans l’alvéole permet d’obtenir une reconstitution rapide de l’alvéole osseuse, sans résorption. La présence de BMP libérées de manière régulière et lente peut expliquer cette ossification rapide sans perte de volume.
Les monocytes jouent manifestement un rôle non négligeable dans la revascularisation du tissu lésé ou greffé. Nous ne sommes qu’au début de cette nouvelle vois de recherche. Pour cela d’autres études seront nécessaires pour améliorer nos connaissances et valider cette théorie.
Bibliographie
1. Marx RE, Carlson ER, Eichstaedt RM, Schimmele SR, Strauss JE, Georgeff KR. Platelet-rich plasma: Growth factor enhancement for bone grafts. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1998 Jun;85(6):638-46.
2. Choukroun J, Adda F, Schoeffler C, Vervelle A. Une opportunité en paro-implantologie : le PRF Implantologie 2001 Implantodontie 2001, vol.42 ;55-62
3. Dohan Ehrenfest DM, de Peppo GM, Doglioli P, Sammartino G. Slow release of growth factors and
thrombospondin-1 in Choukroun's platelet-rich fibrin (PRF): a gold standard to achieve for all surgical platelet
concentrates technologies. Growth Factors. 2009;27(1):63-9.
4. Simonpieri A, Del Corso M, Vervelle A, Jimbo R, Inchingolo F, Sammartino G, Dohan Ehrenfest DM.
Current knowledge and perspectives for the use of platelet-rich plasma (PRP) and platelet-rich fibrin (PRF) in
oral and maxillofacial surgery part 2: Bone graft, implant and reconstructive surgery. Curr Pharm
Biotechnol. 2012;13(7):1231-56
5. Mazor Z, Horowitz RA, Del Corso M, Prasad HS, Rohrer MD, Dohan Ehrenfest DM. Sinus floor
augmentation with simultaneous implant placement using Choukroun's platelet-rich fibrin as the sole grafting
material: a radiologic and histologic study at 6 months. J Periodontol. 2009;80(12):2056-64.
6. Pradeep AR, Bajaj P, Rao NS, Agarwal E, Naik SB. Platelet-Rich Fibrin Combined With a Porous
Hydroxyapatite Graft for the Treatment of Three-Wall Intrabony Defects in Chronic Periodontitis: A
Randomized Controlled Clinical Trial. J Periodontol. 2012
7. Weibrich G, Kleis WK, Hafner G, Hitzler WE, Wagner W. Comparison of platelet, leukocyte, and growth
factor levels in point-of-care platelet-enriched plasma, prepared using a modified Curasan kit, with
preparations received from a local blood bank. Clin Oral Implants Res. 2003;14(3):357-62.
8. Dohan Ehrenfest DM, Bielecki T, Del Corso M, Inchingolo F, Sammartino G. Shedding light in the
controversial terminology for platelet-rich products: platelet-rich plasma (PRP), platelet-rich fibrin (PRF),
platelet-leukocyte gel (PLG), preparation rich in growth factors (PRGF), classification and commercialism. J Biomed Mater Res A. 2010;95(4):1280-2.
9. Davis GE, Stratman AN, Sacharidou A, Koh W. Molecular basis for endothelial lumen formation and tubulogenesis during vasculogenesis and angiogenic sprouting. Int Rev Cell Mol Biol. 2011;288:101-65.
10. Omar OM, Granéli C, Ekström K, Karlsson C, Johansson A, Lausmaa J, Wexell CL, Thomsen P.: The stimulation of an osteogenic response by classical monocyte activation. Biomaterials. 2011 Nov;32(32):8190-204.
11. Rocher C, Singla R, Singal PK, Parthasarathy S, Singla DK. Bone morphogenetic protein 7 polarizes THP-1 cells into M2 macrophages. Can J Physiol Pharmacol. 2012 Jul;90(7):947-51.
12. Vicky Nicolaidou, Mei Mei Wong, Andia N. Redpath, Adel Ersek, Dilair F. Baban, Lynn M. Williams, Andrew P. Cope, and Nicole J. Horwood: Monocytes Induce STAT3 Activation in Human Mesenchymal Stem Cells to Promote Osteoblast Formation. PLoS One. 2012 july; 7(7):
13. Pirraco RP, Reis RL, Marques AP. Effect of monocytes/macrophages on the early osteogenic differentiation of hBMSCs: J Tissue Eng Regen Med. 2013 May;7(5):392-400
14. Kawazoe T, Kim HH. Tissue augmentation by white blood cell-containing platelet-rich plasma. Cell Transplant. 2012;21(2-3):601-7.
15. Perbal P. CCN proteins: A centralized communication network J. Cell Commun. Signal. 2013 DOI 10.1007/s12079-013-0193-7