Gestion clinique des périimplantites et données de la littérature
 Gestion clinique des périimplantites et données de la littérature
Gestion clinique des périimplantites et données de la littérature
Comment gérer les périimplantites?. Apport du laser Diode et Erbium-Yag
Auteur : Dr Amandine PARA
Parution LS 77 - Mars 2018

Parution LS 77, Mars 2018
Avec un nombre croissant d’implants posés, la fréquence des infections périimplantaires cause des défis thérapeutiques majeurs. Les données suggèrent que la prévalence des péri-implantites atteint 16 à 25 % des implants et concerne 20 % des patients sur une période de 5 à 10 ans après la pose (Derks 2015, Pommer 2016).
La péri-implantite a été définie comme une atteinte inflammatoire des tissus mous entourant un implant, accompagnée d’une perte osseuse qui excède la réorganisation physiologique normale. Le diagnostic clinique comprend un saignement au sondage avec ou sans suppuration et une profondeur de poche périimplantaire supérieure ou égale à 5 mm. Radiographiquement, on constate une perte osseuse marginale supérieure ou égale à 2 mm, en général en forme de cuvette. Cette destruction osseuse peut se faire sans aucun signe de mobilité implantaire jusqu'à la perte totale de l'os autour de l'implant (Froum et al, 2016). Une classification a été établie par Schwarz concernant l’étendue de la perte osseuse et le nombre de murs osseux restants. Classe I: le plateau de l’implant reste au niveau crestal (1 à 4 murs osseux verticaux préservés). Cinq sous classes existent en fonction de l’étendue périphérique de la cratérisation. Classe II: le plateau de l’implant est situé au dessus du niveau crestal (perte osseuse verticale des 4 murs osseux). Ces différentes classes peuvent être combinées (fig.1).
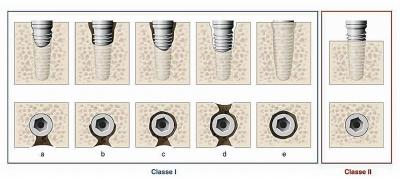
Figure 1: classification des défauts osseux périimplantaires selon leur morphologie d’après Schwartz. Classe 1 : le plateau de l’implant reste au niveau crestal. Une combinaison est possible. Classe1a : déhiscence vestibulaire sans cratérisation, classe 1b : déhiscence vestibulaire avec cratérisation partielle, classe 1c : déhiscence vestibulaire avec cratérisation totale, classe 1d : déhiscence vestibulaire/lingual/palatine avec cratérisation totale, classe 1e : cratérisation sans déhiscence. Classe 2 : cratérisation avec perte osseuse verticale
Le diagnostic différentiel de la péri-implantite est envisagé avec une mucosite (inflammation de la muqueuse périimplantaire seule, sans perte osseuse), une surcharge occlusale, et une lésion inflammatoire apicale au niveau de l’implant.
La péri-implantite, d’origine plurifactorielle, est initiée par la présence d’un biofilm bactérien sur la surface de l’implant, porteur de plus de 75% de bactéries pathogènes gram négatif anaérobies (Para, 2015), qui interagit avec le tissu hôte menant à la destruction de l'os de soutien. D’autres « facteurs déclenchants » pourraient agir en synergie avec l’activité bactérienne : des lésions de l’attache périimplantaire (prothèse débordante, excès de ciment…), la présence d’une parodontite non traitée avant la pose des implants ou des antécédents de parodontites modérées à sévère (Gatti, 2008), un stress mécanique excessif et la corrosion de l’implant. Des facteurs de risque comparables à ceux d’une parodontite tels que la plaque dentaire et une mauvaise hygiène bucco-dentaire, le tabac et le diabète participent également à l’installation de la maladie.
A ce jour, il n’y a aucun consensus ni aucun protocole de traitement standardisé sur le traitement de la péri-implantite. Dans une récente revue de la littérature dans la Cochrane Library, les auteurs ont conclu qu'il y a très peu de preuves fiables suggérant quelles pourraient être les interventions les plus efficaces (Esposito, 2008).
Toutefois depuis 2015, plusieurs auteurs s’accordent sur des points clés qui nous aident à orienter notre attitude thérapeutique (Romanos, 2015). La gestion idéale de la péri-implantite se concentre sur le contrôle de l’inflammation, la décontamination de la surface implantaire et la régénération éventuelle de l’os résorbé.
-
La modification de la topographie superficielle de l’implant (par traitement mécanique et chimique), associée ou pas à une régénération osseuse guidée, semble réduire significativement les signes cliniques de péri-implantite.
-
La transformation de l’environnement muqueux péri implantaire en cas de faible épaisseur ou d’absence de gencive kératinisée permet une augmentation de l’attache muqueuse au contact de spires implantaires non recouvertes par de l’os (Zuchelli, 2013).
Récemment, l’intégration des technologies photoniques lasers à l’arsenal thérapeutique a été proposée. Plusieurs protocoles à l’étude actuellement semblent donner des résultats intéressants.
Indépendamment de la technique employée, notre responsabilité de praticiens cliniciens de plus en plus confrontés à cette maladie ne nous autorise pas à rester indécis voire inactifs dans l’attente de publications consensuelles sur la meilleure conduite thérapeutique. Face à une péri-implantite, nos préoccupations seront les suivantes : quels sont les objectifs personnalisés du traitement ? Comment décontaminer efficacement les surfaces implantaires ? Comment gérer le contexte osseux et muqueux absent ?
En réponse à ces questions, nous exposerons les résultats de notre revue de littérature avant de proposer au travers de deux cas cliniques un exemple de gestion laser assistée des péri-implantites.
Quels sont les objectifs du traitement des péri-implantites ?
Le but principal du traitement est de maintenir l’implant fonctionnel et de prévenir la récurrence de l’infection péri-implantaire. Pour ce faire il s’agira d’éliminer le tissu de granulation adhérent à l’implant, de recréer un environnement local favorable à l’hygiène du patient et d’aménager le profil ostéomuqueux afin de faciliter sa cicatrisation voire sa régénération.
La phase unique non chirurgicale (débridement ultrasonore supragingival à l’aveugle et aéropolissage) apparait souvent suffisante pour la réduction des saignements au sondage dans les cas de mucosite mais a été documentée comme étant inadéquate pour gérer les péri-implantites avérées. D’une part, le tissu de granulation est fermement attaché à la surface implantaire et à la muqueuse de la face interne de la poche. D’autre part, la lésion se présente sous forme de cratère et il est très difficile d’accéder aux zones linguales ou palatines sans un accès visuel direct sur cette lésion. Seules les thérapies chirurgicales (à ciel ouvert avec lambeau) aboutissent à une réduction de la profondeur des poches, du saignement au sondage et au minimum à une stabilisation du niveau osseux.
Les exigences de traitement diffèrent en fonction de la localisation des implants :
En secteur postérieur dans la plupart des cas, chez un patient ayant une bonne hygiène, aucun enjeu esthétique n’impose de recouvrir les surfaces implantaires exposées visibles. La décontamination préalable de la surface implantaire est la solution thérapeutique de première intention. Elle favorise un gain d’attache clinique et une stabilisation osseuse à long terme (Nguyen Hieu, 2012). Le gain d’attache clinique peut être optimisé par l’apport de tissu conjonctif enfoui sous un lambeau déplacé coronairement (Zuchelli, 2013).
En secteur antérieur, la décontamination initiale a le même objectif qu’en secteur postérieur. Cependant lorsque le positionnement de l’implant est trop vestibulaire, le pronostic de recouvrement par les tissus mous (avec ou sans apport de conjonctif) de la surface implantaire n’est pas prédictible. De ce fait en secteur antérieur, une attitude thérapeutique viable consiste parfois à déposer l’implant trop vestibulé, reconstruire le profil de la crête (tissus durs ou tissus mous principalement selon le cas) puis reposer un implant.
Mais peut-on décontaminer efficacement les surfaces implantaires ?
Récemment, une revue de littérature a présenté une vue d'ensemble de divers protocoles de détoxification de la surface implantaire décrits entre 2010 et 2015 (Mahato 2016) selon deux voies :
-
Par des procédures mécaniques (nettoyage avec une brossette titane de type Tibrush® de Straumann, implantoplastie à la fraise diamantée et polissage ou photoablation laser de la couche superficielle de dioxyde de titane contaminée)
-
Par des procédures chimiques (détoxification de la surface par aéropolissage avec une poudre d’érythrol ou détoxification à l’eau oxygénée, à l’acide citrique à 20% ou à l’acide phosphorique à 35%) (Drago, 2017).
Aujourd’hui les meilleurs résultats cliniques à 4 ans sont obtenus par la combinaison des deux types de procédures, mécanique et chimique : tout le tissu de granulation doit être éliminé en amont, la surface exposée de l’implant devant être nettoyée théoriquement avec des instruments en titane. La surface de l’implant peut ensuite être décontaminée chimiquement avec de l’eau oxygénée à 10 volume. Un nettoyage mécanique de la surface implantaire avec un jet de poudre abrasive associée à une irrigation d’une solution saline termine la procédure.
En fonction de l’étendue de l’infection, du type de bactéries et de l’état de santé du patient, il est possible de prescrire des antibiotiques par combinaison d’amoxicilline et métronidazole.
En ce qui concerne l’implantoplastie, l’objectif recherché serait de recréer une surface lisse sans spires peu favorable à l’adhésion bactérienne. L’implantoplastie ne semble pas altérer significativement le diamètre externe de l’implant ni sa résistance à la fracture. Toutefois, quid du devenir des débris de titane et des débris polymériques après implantoplastie dans les tissus périimplantaires ? Les données à long terme sur l’impact de ces débris sur la stabilité des tissus périimplantaires restent encore peu connues (Costa-Berenger 2017, Pommer 2016).
Comment gérer l’environnement ostéomuqueux ?
La présence d’une gencive kératinisée épaisse constitue un rempart biologique primordial pour la stabilité de l’environnement ostéomuqueux péri implantaire même en cas d’absence de mur osseux vestibulaire. Si la reconstruction osseuse par apport de matériau n’est pas systématique, la transformation du biotype muqueux en cas de manque de tissu kératinisé est capitale, en secteur antérieur comme en secteur postérieur. La revue de littérature la plus récente (Bassetti 2017) conclue à une supériorité significative du lambeau avancé coronairement associé à un conjonctif enfoui pour augmenter le tissu kératinisé autour des implants. On note un résultat moins intéressant des techniques de lambeau associées à une matrice xénogénique.
Concernant la gestion des défauts osseux proprement dits, l’association à une régénération osseuse guidée dépend de l’anatomie du défaut osseux péri implantaire (classification de Schwarz). Les défauts intra-osseux contenus, en présence de parois osseuses résiduelles pour soutenir le greffon, sont plus adaptés pour une approche régénératrice que les défauts non contenus (Schwarz, 2014).
Quelle est la place du laser dans le traitement des péri-implantites ?
La plupart du temps, la surface rugueuse des implants fournit des niches bactériennes inaccessibles au débridement mécanique conventionnel. La motivation principale à chercher des méthodes alternatives est d’améliorer le processus de décontamination et de régénération tissulaire sur la surface implantaire ainsi que la stabilité de la cicatrisation osseuse à long terme. L'utilisation du laser comme une méthode alternative pour le traitement des péri-implantites a augmenté depuis 2015 (Aoki, 2015).
Trois champs d’action entrent en synergie :
-
D’abord, l’effet laser photoablatif. Il est réalisé à l’aide d’un laser Erbium pour le curetage chirurgical du tissu de granulation. L'utilisation de lasers absorbés dans l’eau et dans l’hydroxyapatite de type Erbium-Yag (2940 nm) est recommandée par leur capacité à éliminer le tissu de dégranulation (Yoshino, 2015). La recherche clinique actuelle (Mailoa 2014, Schwarz 2017) soutient l'utilisation du laser Erbium-Yag pour l’efficacité de la décontamination de la surface implantaire sans augmentation significative de la température avec une bonne irrigation (Monzavi, 2014) et pour l’attachement deux fois plus rapide des cellules ostéoblastiques sur les surfaces osseuses traitées au laser erbium par rapport aux surfaces réséquées à la fraise diamantée (Pourzarandian, 2005)
-
Deuxièmement, la désinfection photoactivée. Elle est possible par thérapie photodynamique à l’aide d’un laser diode entre 635 et 660nm couplé à un agent photosensible (type phénothiazine ou bleu de toluidine) ou par thérapie photochimique avec un laser diode 980nm en milieu préalablement oxygéné par de l’eau oxygénée à 10 volumes. La thérapie photodynamique (PDT) est fondée sur une réaction photochimique comprenant trois composants : l’agent photosensibilisant (PS), l'oxygène et la lumière. Le mécanisme de la PDT dépend de l'attachement du PS à des cellules cibles privilégiées que sont les bactéries anaérobies (Saffapour, 2016). En raison de sa charge cationique, le bleu de toluidine est capable de s’attacher à la membrane extérieure de bactéries gram-négatif. La longueur d'onde absorbante maximale de cette teinture est la longueur d'onde diode à 632 ± 8nm. Les études montrent que quand ce PS est activé par la lumière appropriée, il délivre une énergie permettant de convertir les molécules d’oxygène local en radicaux libres oxygénés excités bactéricides. Ces derniers sont capables de rompre les liaisons peptidiques de la membrane des bactéries anaérobies, dépourvues de catalase et de péroxydase. Par ailleurs le bleu de toluidine peut infiltrer la couche de dioxyde de titane TiO2 de la surface implantaire colonisée par des bactéries. La thérapie photodynamique peut ainsi prétendre à éliminer efficacement des bactéries parodontopathogènes comme Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis et le Fusobacterium nucleatum impliqués dans la génèse des péri-implantites (Birang, 2017). En outre, l’association de la thérapie photodynamique classique avec un agent photosensibilisant et d’une thérapie photochimique par l’action d’un laser diode 980nm ou 970nm sous eau oxygénée potentialise l’effet antibactérien dans l’environnement périimplantaire. Le laser diode 980nm ou 970nm est une longueur d’onde pénétrante, absorbée par l’hémoglobine. Cette absorption favorise la vasodilatation et l’arrivée sur le site de sang chargé en facteurs de croissance. Ce sang mélangé à l’oxygène apporté en grande quantité aide la reconstruction tissulaire par l’augmentation des échanges respiratoires cellulaires. Enfin, l’effet thermique de ce laser à puissance de crête élevée (2.5W) est contrôlé par la présence de périodes de repos sans tirs, en mode superpulsé par exemple (cycle de tirs de 30%, 33µs, 8000Hz) qui diminuent la puissance moyenne et l’énergie globale accumulée. Le stress thermique ainsi généré permet de stimuler des protéines de choc thermique (HSP70) qui assurent la réparation tissulaire (Papadopoulos, 2015).
-
Troisièmement, la photostimulation ou photobiomodulation. L’utilisation de lasers de très faible puissance moyenne et à faible niveau d’énergie comme l’ATP38 (LLLT, low level laser therapy ou softlasers) permet de réduire l'inflammation et d’améliorer la régénération tissulaire. Les traitements laser à faible niveau énergétique aboutissent à l'activation de la voie du TGF-b1 connu pour initier l'expression de HBD-2 (human β defensin 2) impliqué dans le fonctionnement de plusieurs cellules tapissant la cavité buccale, tels les kératinocytes, les fibroblastes, les neutrophiles et les cellules endothéliales (Tang, 2017).
Nous en déduisons que tous les effets lasers ne sont pas réalisables avec une seule longueur d’onde. Afin de mieux traduire la synergie entre ces effets, nous suggérons dans cet article un schéma du mécanisme d’action des lasers dans le traitement des péri-implantites inspiré par les études de Tang en 2017 (fig.2).
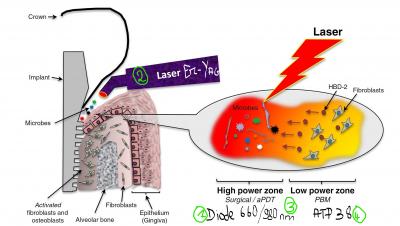
Figure 2: synergie des effets laser dans le traitement des péri-implantites. 1/ Thérapie photodynamique bactéricide du laser Diode 660nm (faible énergie) avec agent photosensible. 2/Effet mécanique du laser Erbium-Yag pour l’élimination du tissu de granulation. 3/Effet photochimique complémentaire du laser diode 980nm (haute énergie) avec eau oxygénée. 4/Photobiomodulation du laser ATP 38 (faible énergie) pour la stimulation de la cicatrisation et son effet antiinflammatoire.
Les deux cas cliniques ci-après illustrent notre propos.
Cas n°1 :
Il s’agit d’une patiente de 65 ans, portant 6 implants de longueur 12mm posés il y a 8 ans. Elle présente des signes de péri-implantite secteur 1 et secteur 4 : saignement au sondage, profondeur de poche 4 à 8mm, cratère osseux radiologique et perte osseuse verticale (fig.3, fig.4)
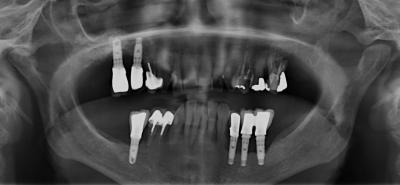
Figure 3: situation initiale de la périimplantite secteur 1 et secteur 4
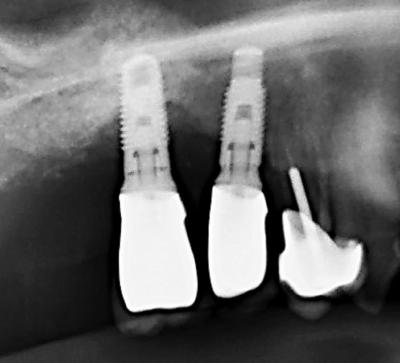
Figure 4: perte osseuse périimplantaire en forme de cuvette autour de l'implant 16
Nous nous intéressons au traitement des implants au secteur 1, notre démarche décisionnelle est la suivante :
-
Critères diagnostiques : secteur postérieur, présence de tissu kératinisé faible mais suffisante, présence de murs osseux (classe 2 de Schwarz, selon examen du cone beam), mauvais contrôle d’hygiène par la patiente (fig.5)
-
Orientation thérapeutique : élimination du tissu de granulation, décontamination de la surface implantaire, aménagement muqueux, ROG pas indispensable mais décision à valider en peropératoire selon l’anatomie exacte du défaut osseux.
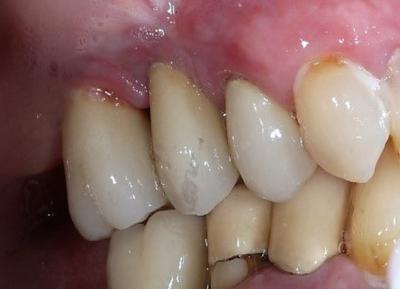
Figure 5: suppuration et saignement après sondage, présence de muqueuse attachée en faible quantité
Le traitement a été réalisé selon la séquence opératoire suivante : débridement ultrasonore supragingival (fig.6), thérapie photodynamique à l’aide de laser Diode Helbo et de bleu de toluidine. L’agent coloré photosensible est déposé dans la poche, laissé en place 3 minutes afin de se fixer sur les membranes bactériennes, puis rincé à l’aide d’eau oxygénée. La fibre du laser Helbo est alors insérée au fond de la poche (fig.7) et activée 10s par site, sur six sites différents (vestibulo mésial/distal/central et palato mésial/distal/central). D’une façon générale, la thérapie photodynamique à l’aide d’un agent coloré photosensible doit être réalisée en l’absence de saignement important, donc avant de lever un lambeau muqueux.
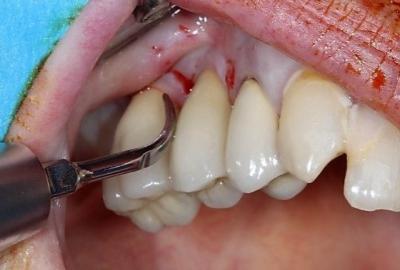
Figure 6: étape initiale de débridement ultrasonore supragingival
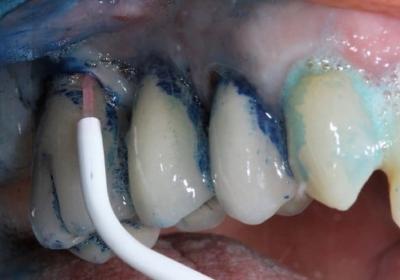
Figure 7: thérapie photodynamique avec le laser Helbo 660nm. Le bleu de toluidine a été laissé en place durant 3 minutes au fond des poches, puis rincé à l'aide d'eau oxygénée. La fibre laser est insérée au fond de la poche et maintenue immobile en place sur 6 sites autour de l’implant, durant 10 secondes par site
Après la phase de thérapie photodynamique, un lambeau de pleine épaisseur est réalisé à l’aide du laser Erbium-Yag (170mJ/15Hz/3.4W) (fig.8). La fibre de 600µm est orientée de façon à réaliser une découpe à biseau interne dans l’épaisseur de la muqueuse afin de séparer le tissu de granulation de la face interne du lambeau. Ceci est possible en raison de la différence de charge hydrique existant entre le tissu de granulation (fortement chargé en eau) et la muqueuse saine. Le rayonnement laser 2940 nm de l’erbium sera préférentiellement absorbé par le tissu de granulation donc découpera plutôt le tissu de granulation. Une fois le lambeau récliné à l’aide d’un syndesmotome faucille et d’un décolleur de Molt, on objective bien la densité du tissu de granulation(fig.9). Ce tissu encore attaché à l’os et à la surface implantaire est retiré à l’aide du laser Erbium (fibre 600µm, 3.2W 20Hz, 160mJ), en dirigeant les impacts laser vers l’attache osseuse. La surface implantaire est ensuite débridée mécaniquement toujours à l’aide du laser Erbium avec un paramétrage moins énergétiques : 60mJ, 30Hz, 5%air 5% eau afin d’éliminer le reste de tissu de granulation niché entre les spires. Le changement d’aspect de la texture de la surface implantaire est visible à l’aide d’aides optiques, il signe l’élimination d’une partie de la couche superficielle de dioxyde de titane contaminée (fig.10).
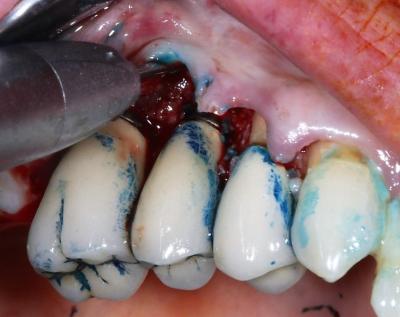
Figure 8: réalisation d'un lambeau de pleine épaisseur à l'aide du laser Erbium-Yag. La fibre de 600µm est orientée de façon à réaliser en mode défocalisé (à distance de la muqueuse) une dissection à biseau interne et détacher le tissu de granulation de la face interne de la poche. La charge hydrique plus importante du tissu de granulation est responsable d’une absorption préférentielle de la longueur d’onde 2940nm par ce tissu.
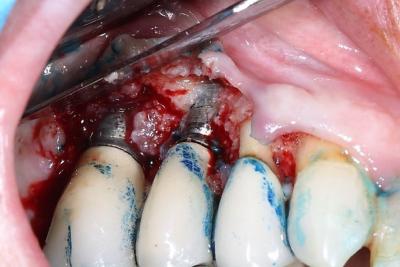
Figure 9: on note la densité du tissu de granulation attaché à l’os et à la surface implantaire
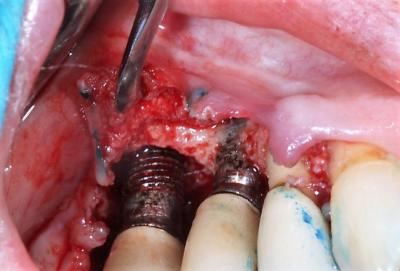
Figure 10: situation clinique après nettoyage des surfaces implantaires et réalisation d'impacts sur la corticale pour ouvrir les canaux de Havers et permettre l’arrivée de sang sur le site
A ce stade, il est nécessaire d’analyser l’anatomie du défaut osseux : nous sommes en présence d’une classe 2 de Schwarz. Les murs du cratère ne sont pas très haut sur l’implant 16, et il n’y a pas de cratère sur l’implant 15. La décision de ne pas réaliser de ROG est confirmée. Une décontamination chimique est ensuite réalisée à l’aide d’un aéropolissage de poudre de bicarbonate et d’un bain d’eau oxygénée laissé en place quelques minutes sur la surface implantaire. Un laser Diode pénétrant de 980nm est enfin utilisé en mode superpulsé (0,45W puissance moyenne, cycle de tirs 30% 33µs) afin de créer une vasodilatation et d’augmenter localement l’afflux de facteurs de la cicatrisation(fig.11). Dans ce cas, le sang mélangé à l’eau oxygénée est laissé en place et bien contenu dans le cratère osseux. Le lambeau est suturé par des points matelassiers horizontaux (fig.12). Une biostimulation est réalisée en fin de séance à l’aide du laser ATP38 (fig.13).
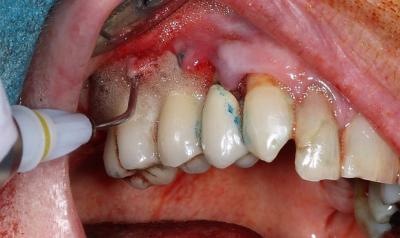
Figure 11: thérapie photochimique à l'aide du laser Diode 980nm pour favoriser la concentration de facteurs de cicatrisation. L’effet thermique de ce laser à puissance de crête élevée (2.5W) est contrôlé par son mode superpulsé (cycle de tirs de 30%, 33µs, 8000Hz) qui diminue la puissance moyenne et l’énergie globale accumulée. Ce stress thermique permet de stimuler des protéines de choc thermique (HSP70) qui assurent la réparation tissulaire.
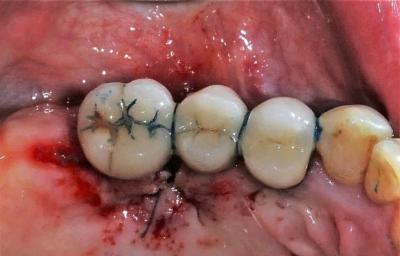
Figure 12: situation postopératoire immédiate après sutures, vue palatine
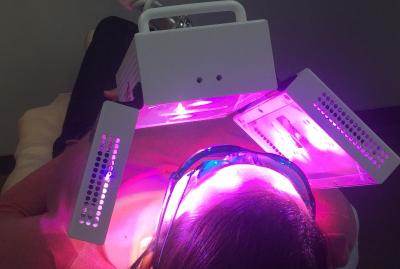
Figure 13 : photostimulation ou photobiomodulation à l'aide du laser ATP38, sollicitant jusqu'à 8 longueurs d'onde différentes. Ici en mode « antiinflammatoire, antidouleur, cicatrisation ».
A 15 jours postopératoires, on note une disparition des signes cliniques de péri-implantite (fig.14) : plus de saignement au sondage et diminution de la profondeur de poche. Radiographiquement à 4 mois postopératoires, on note une densification du cratère osseux en accord avec l’amélioration des signes cliniques (fig.15). Le pronostic de stabilisation de la maladie péri implantaire semble bon, à condition de respecter un programme de maintenance laser assisté : une séance de nettoyage suivie de thérapie photodynamique à l’Helbo 2, 4, 6 et 8 mois postopératoires ou de thérapie photochimique au laser Diode 980nm. Le choix du laser dépendra de différents critères d’évaluation de la situation clinique initiale à chaque séance de maintenance.
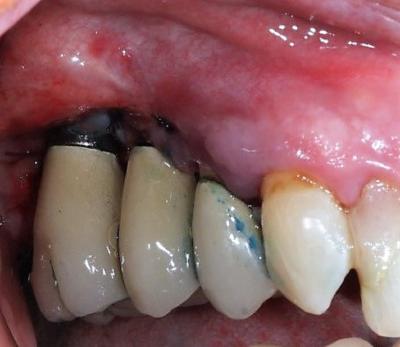
Figure 14 : vue vestibulaire de la cicatrisation à 15 jours postopératoires, on note la disparition des signes cliniques de périimplantite.
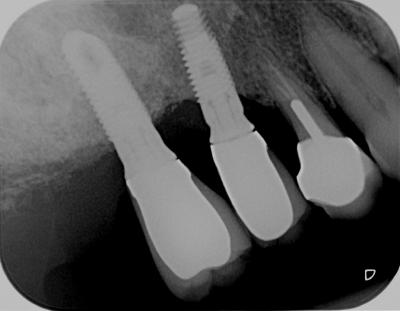
Figure 15: cicatrisation osseuse à 4 mois. Comblement satisfaisant du cratère osseux, en corrélation avec une disparition des signes cliniques de périimplantite
Cas n°2
Il s’agit de 3 implants posés en site 14 15 16 il y a 7 ans dans un os greffé sous sinusien. La patiente de 70 ans, ressent un inconfort au niveau de ses implants. Cliniquement, on obtient une suppuration et un saignement au sondage avec une profondeur de poche de 7mm. Radiographiquement, on note une zone moins dense au niveau du tiers coronaire des implants (fig.16, fig.17). La présence d’un cratère osseux périimplantaire est confirmée sur le cone beam et par le sondage.
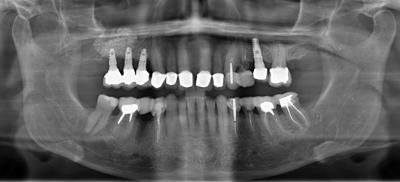
Figure 16: vue radiographique initiale de l’aspect osseux radioclair autour des implants secteur 1 placés dans un os greffé
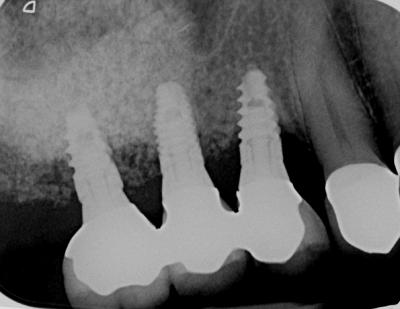
Figure 17: radiographiquement on devine que tous les murs osseux ne sont pas détruits. Ceci est confirmé par une vue tomographique sur un cone beam.
Le protocole de traitement est identique au cas n°1 : débridement supragingival, thérapie photodynamique au laser diode Helbo associé au bleu de toluidine, avant décollement du lambeau de pleine épaisseur au laser Erbium-Yag. On remarque la densité du tissu de granulation avec des restes de particules de l’ancienne greffe sinusienne, ainsi qu’un important excédent de ciment de scellement sur les spires vestibulaires de l’implant 14 (fig.18, fig.19). Le site est nettoyé à l’aide du laser Erbium, 170 mJ au niveau osseux et 60 mJ pour décontaminer et retexturer la surface implantaire : on note alors un aspect plus mat et moins luisant de la surface implantaire débarrassée de la couche superficielle de dioxyde de titane infiltrée. La corticale osseuse est ensuite impactée par les tirs du laser erbium pour augmenter l’afflux sanguin en ouvrant les canaux de Havers (fig.20).
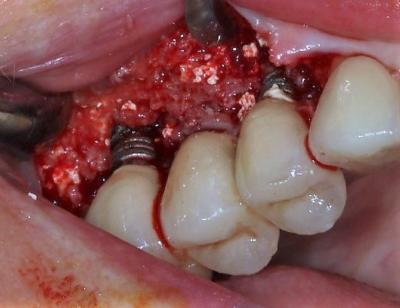
Figure 18: réalisation d'un lambeau de pleine épaisseur au laser Erbium-Yag, le tissu de granulation reste attaché à l'os.
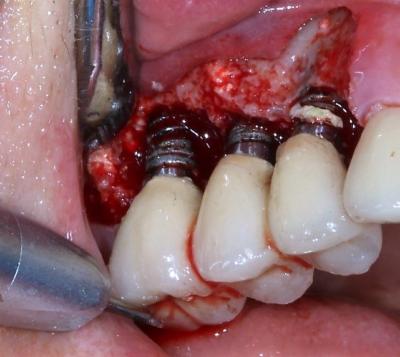
Figure 19: différents facteurs défavorables sont présents comme d’anciennes particules de régénération osseuse guidée et la présence de fusée de ciment de scellement.
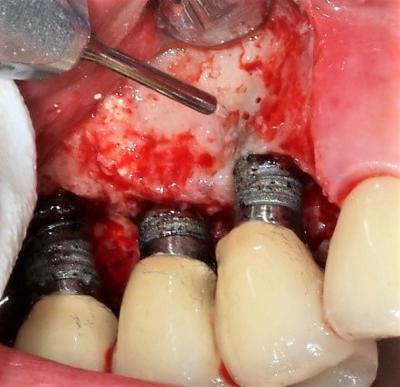
Figure 20: après retrait du tissu de granulation et nettoyage des surfaces implantaires à l'Erbium-Yag, des impacts sont réalisés sur la corticale osseuse afin d'augmenter l'arrivée de sang sur le site.
A ce stade du protocole, on confirme qu’il s’agit d’une classe 2 de Schwarz avec des murs osseux entourant un cratère relativement profond autour des implants 15 16 : nous réaliserons une régénération osseuse guidée. La surface implantaire est nettoyée par aéropolissage sous gingival de bicarbonate (tête spéciale EMS permettant une arrivée de l’air sur les secteurs latéraux de la buse en plastique), puis décontaminée à l’aide d’eau oxygéné à 10 volumes (fig.21, fig.22). Le laser diode 980 nm est ensuite activé afin de favoriser l’apport de sang oxygéné sur le site. Les particules de ROG (Creos Xenogain, Nobel) sont positionnées au fond du cratère et sur la surface implantaire recouverte d’une membrane de collagène résorbable (Creos Xenoprotect, Nobel) (fig.23, fig.24). Le lambeau est enfin suturé (fig.25).
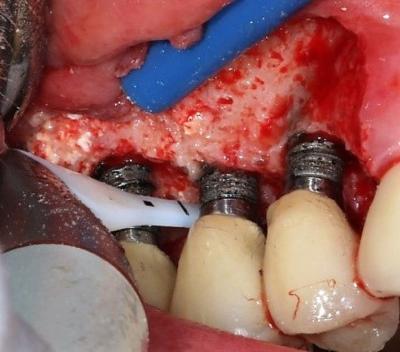
Figure 21: les surfaces implantaires sont décontaminées par aéropolissage sous gingival.
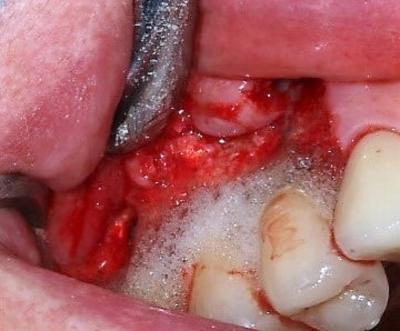
Figure 22: eau oxygénée laissée en place afin de décontaminer la surface implantaire et oxygéner le milieu avant thérapie photochimique par le laser Diode 980nm
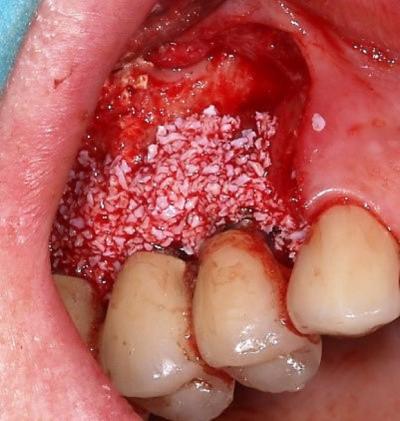
Figure 23: régénération osseuse guidée par des particules d'origine bovine (Creos Xenogain, Nobel)
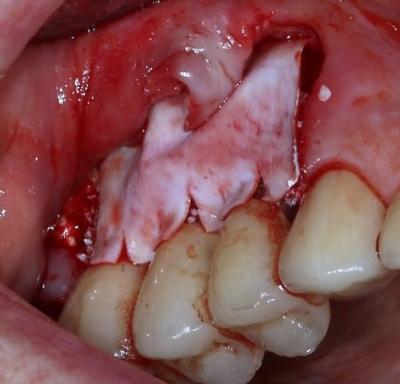
Figure 24: protection de la ROG par une membrane collagène (Creos Xenoprotect, Nobel) afin d'éviter la compétition cellulaire entre les fibroblastes de la face muqueuse et les ostéoblastes en provenance de la surface osseuse
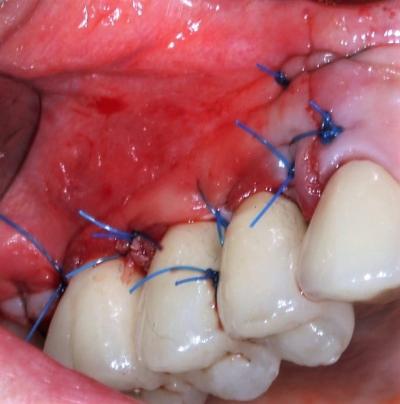
Figure 25: fermeture du site par des sutures en matelassier vertical
La cicatrisation à 3 semaines montre une bonne cicatrisation muqueuse avec une légère récession compatible avec la réduction de profondeur de poche (fig.26, fig.27). Cliniquement il n’y a plus de suppuration ni de saignement au sondage et la sensation d’inconfort de la patiente a disparu. Le jour de la dépose des fils de suture, on remarque une légère inflammation muqueuse, le laser diode 980nm est activé sous eau oxygénée afin d’apporter du sang oxygéné et d’améliorer la cicatrisation (fig.28, fig.29).
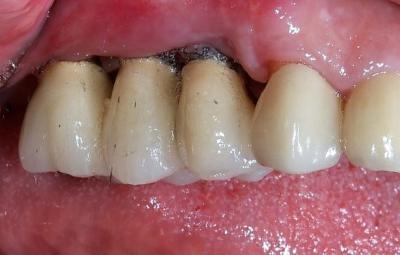
Figure 26: thérapie photochimique complémentaire lors de la dépose des fils de suture pour son effet antiinflammatoire et l'apport de cellules souches dans le sang oxygéné
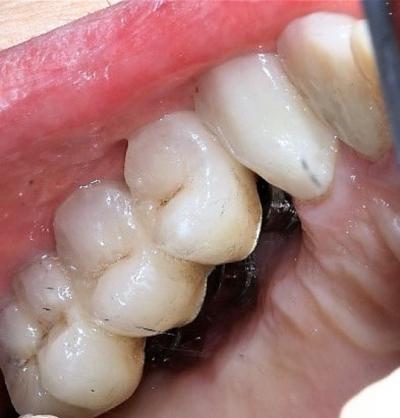
Figure 27: vue palatine du sang oxygéné qui reste en place en fin de thérapie photochimique
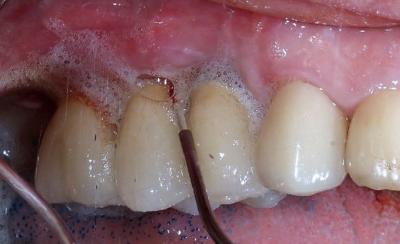
Figure 28: cicatrisation à 1 mois, on note une légère récession gingivale
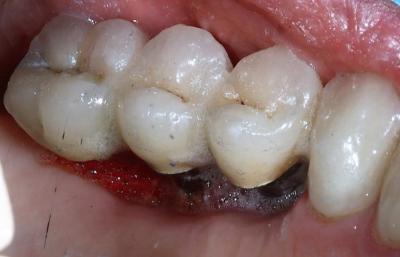
Figure 29: bon aspect de la cicatrisation coté palatin, avec reformation d'une muqueuse kératinisée dense entre les implants.
Un programme de maintenance avec application de thérapie photodynamique Helbo à 2, 4, 6 et 8 mois est proposé à la patiente. En postopératoire immédiat et à chaque visite du patient, une biostimulation laser par ATP 38 est réalisée pour son effet de biostimulation : antiinflammatoire, antidouleur et cicatrisant (fig.30).

Figure 30: photostimulation par ATP 38 réalisée à chaque séance de maintenance, ici en mode « biostimulation »
En conclusion, s’il n’est pas évident de traiter la péri-implantite, comment pourrait-on l’éviter ?
Eviter la péri-implantite est une utopie.
Il semble y avoir encore aujourd’hui une complémentarité entre plusieurs facteurs déclenchants qui nous échappe…combien de fois avons-nous déjà remarqué une bouche parfaitement saine avec un ou plusieurs implants atteints ? Ou un implant en péri-implantite avancée adjacent à un implant sain ? Ou à l’inverse une bouche atteinte de maladie parodontale sévère avec des implants parfaitement préservés ?
La démarche de prévention sera focalisée sur des facteurs étiologiques connus systématiques et maitrisables comme le facteur bactérien. Le fait que l'espèce bactérienne pathogène détectée autour des sites en péri-implantite soit semblable à celle trouvée autour des dents naturelles atteintes de maladie parodontale laisse penser que la génèse de la péri-implantite est semblable à celle de la parodontite.
Quelques suggestions…
Réaliser par exemple un test bactérien voire un test génétique PST en amont de toute pose d’implant serait une conduite préventive en préchirurgical.
Réduire par exemple les facteurs de risque modifiables (diminution du tabac grâce à l’hypnose (?), apprentissage de l’hygiène buccale, contrôle radiographique après scellement, greffe mucogingivale systématique en cas d’absence de muqueuse kératinisée, port d’une gouttière nocturne et contrôle périodique de l’occlusion) est une orientation de prévention en postchirurgical.
Quelle que soit l’efficacité de ces précautions, notre succès thérapeutique face à une péri-implantite déclarée dépendra de notre capacité à analyser l’anatomie du cratère en peropératoire et à personnaliser la surveillance postopératoire du patient selon ses besoins.
Bibliographie
-
Aoki A, Mizutani K, Schwarz F, Sculean A, Yukna RA, Takasaki AA, Romanos GE, Taniguchi Y, Sasaki KM, Zeredo JL, Koshy G, Coluzzi DJ, White JM, Abiko Y, Ishikawa I, Izumi Y. Periodontal and peri-implant wound healing following laser therapy. Periodontol 2000. 2015 Jun;68(1):217-69.
-
Birang E, Talebi Ardekani MR, Rajabzadeh M, Sarmadi G, Birang R, Gutknecht N. Evaluation of Effectiveness of Photodynamic Therapy With Low-level Diode Laser in Nonsurgical Treatment of Peri-implantitis. J Lasers Med Sci. 2017 Summer;8(3):136-142.
-
Costa-Berenguer X, García-García M, Sánchez-Torres A, Sanz-Alonso M, Figueiredo R, Valmaseda-Castellón E. Effect of implantoplasty on fracture resistance and surface roughness of standard diameter dental implants. Clin Oral Implants Res. 2017 Jul 23.
-
Derks J1, Tomasi C. Peri-implant health and disease. A systematic review of current epidemiology. J Clin Periodontol. 2015 Apr;42 Suppl 16:S158-71.
-
Drago L, Bortolin M, Taschieri S, De Vecchi E, Agrappi S, Del Fabbro M, Francetti L, Mattina R. Erythritol/chlorhexidine combination reduces microbial biofilm and prevents its formation on titanium surfaces in vitro. J Oral Pathol Med. 2017 Sep;46(8):625-631.
-
Esposito M, Grusovin MG, Coulthard P, Worthington HV. The efficacy of interventions to treat peri-implantitis: a Cochrane systematic review of randomised
-
Froum SJ, Dagba AS, Shi Y, Perez-Asenjo A, Rosen PS, Wang WC. Successful Surgical Protocols in the Treatment of Peri-Implantitis: A Narrative Review of the Literature. Implant Dent. 2016 Jun;25(3):416-26.
-
Gatti C, Gatti F, Chiapasco M, Esposito M. Outcome of dental implants in partially edentulous patients with and without a history of periodontitis: a 5-year interim analysis of a cohort study. Eur J Oral Implantol. 2008 Spring;1(1):45-51.
-
Bassetti RG, Stähli A, Bassetti MA, Sculean A. Soft tissue augmentation around osseointegrated and uncovered dental implants: a systematic review. Clin Oral Investig. 2017 Jan;21(1):53-70.
-
Mahato N, Wu X, Wang L. Management of peri-implantitis: a systematic review, 2010-2015.Springerplus. 2016 Feb 1;5:105.
-
Mailoa J, Lin GH, Chan HL, MacEachern M, Wang HL. Clinical outcomes of using lasers for peri-implantitis surface detoxification: a systematic review and meta-analysis. J Periodontol. 2014 Sep;85(9):1194-202.
-
Mombelli A, Lang NP. The diagnosis and treatment of peri-implantitis. Periodontology 2000. 1998;17:63-76.
-
Monzavi A, Shahabi S, Fekrazad R, Behruzi R, Chiniforush N. Implant Surface Temperature Changes during Er:YAG Laser Irradiation with Different Cooling Systems. J Dent (Tehran). 2014 Mar;11(2):210-5.
-
Nguyen-Hieu T, Borghetti A, Aboudharam G. Peri-implantitis: from diagnosis to therapeutics. J Investig Clin Dent. 2012;3:79-94.
-
Papadopoulos CA, Vouros I, Menexes G, Konstantinidis A. The utilization of a diode laser in the surgical treatment of peri-implantitis. A randomized clinical trial. Clin Oral Investig. 2015 Nov;19(8):1851-60. doi: 10.1007/s00784-014-1397-9.
-
Para A.Traitement laser assisté des périimplantites DT StudyClub le Magazine 2_2015 : 18-24
-
Pommer B, Haas R, Mailath-Pokorny G, Fürhauser R, Watzek G, Busenlechner D, Müller-Kern M, Kloodt C. Periimplantitis Treatment: Long-Term Comparison of Laser Decontamination and Implantoplasty Surgery. Implant Dent. 2016 Oct;25(5):646-9.
-
Pourzarandian A, Watanabe H, Ruwanpura SM, Aoki A, Ishikawa I. Effect of low-level Er:YAG laser irradiation on cultured human gingival fibroblasts. J Periodontol. 2005 Feb;76(2):187-93.
-
Renvert S, Lindahl C, Roos Jansåker AM, Persson GR. Treatment of peri-implantitis using an Er:YAG laser or an air-abrasive device: a randomized clinical trial. J Clin Periodontol. 2011 Jan;38(1):65-73.
-
Romanos GE, Javed F, Delgado-Ruiz RA, Calvo-Guirado JL. Peri-implant diseases: a review of treatment interventions. Dent Clin North Am. 2015 Jan;59(1):157-78.
-
Saffarpour A, Fekrazad R, Heibati MN, Bahador A, Saffarpour A, Rokn AR, Iranparvar A, KharaziFard MJ. Bactericidal Effect of Erbium-Doped Yttrium Aluminum Garnet Laser and Photodynamic Therapy on Aggregatibacter Actinomycetemcomitans Biofilm on Implant Surface. Int J Oral Maxillofac Implants. 2016 May-Jun;31(3):e71-8. 2014 Sep;85(9):1194-202.
-
Schwarz F, Sahm N, Becker J. Combined surgical therapy of advanced peri-implantitis lesions with concomitant soft tissue volume augmentation. A case series. Clin Oral Implants Res. 2014 Jan;25(1):132-6.
-
Schwarz F, Hegewald A, John G, Sahm N, Becker J. Four-year follow-up of combined surgical therapy of advanced peri-implantitis evaluating two methods of surface decontamination. Journal of Clinical Periodontology. Mar2017, Vol. 44 Issue 3, p337-342.
-
Tang E, Khan I, Andreana S, Arany PR. Laser-activated transforming growth factor-β1 induces human β-defensin 2: implications for laser therapies for periodontitis and peri-implantitis. J Periodontal Res. 2017 Jun;52(3):360-367.
-
Yan M, Liu M, Wang M, Yin F, Xia H. The effects of Er:YAG on the treatment of peri-implantitis: a meta-analysis of randomized controlled trials. Lasers Med Sci. 2015 Sep;30(7):1843-53.
-
Zucchelli G, Mazzotti C, Mounssif I, Marzadori M, Stefanini M. Esthetic treatment of peri-implant soft tissue defects: a case report of a modified surgical-prosthetic approach. Int J Periodontics Restorative Dent. 2013 May-Jun;33(3):327-35.
n