Amélioration des traitements extractionnels et Préservation Alvéolaire Laser Assistée PAL
 Protocole de Préservation Alvéolaire Laser assistée : PAL
Protocole de Préservation Alvéolaire Laser assistée : PAL
Auteur : Dr Thierry Maleca (69 003 Lyon)
Les lasers grâce a leurs interactions tissulaires sont des outils intéressants dans l’amélioration des cicatrisations alvéolaires.
En effet, certains lasers permettent une coagulation du caillot alvéolaire, d’autres décontaminent les tissus pour plus de sécurité et de confort.
Sans compter sur l’apport vasculaire et bio stimulant dont les tissus cibles bénéficient lors des irradiations ; le protocole de Préservation Alvéolaire Laser, (PAL), montre depuis 10 ans des résultats intéressants en terme de fermeture rapide des sites d’extraction, une réduction de l’inflammation, de la douleur, pour le plus grand confort de nos patients.

Fig.1 Cicatrisation à 24H
Les extractions simples ou multiples, sont les actes les plus réalisés au monde, les études multiples décrivent depuis plusieurs décennies, une perte osseuse rapide, irréversible et progressive sur plusieurs mois en post opératoire. (1) (2) (3)
L’extraction suit un protocole simple depuis des années : Anesthésie locale ou loco régionale, suivie d’une syndesmotomie puis mobilisation à l’aide d’un élévateur, curetage alvéolaire si nécessaire et attente de cicatrisation. C’est alors que la résorption osseuse commence pour atteindre environ 21% du volume à 3 mois et entre 40 et 60 % à 3 ans. (4)
Le Protocole Alvéolaire Laser assisté, vient compléter cette avulsion, en irradiant l’alvéole afin de la décontaminer, la coaguler et stimuler sa cicatrisation.
Le temps de cicatrisation est amélioré, l’inflammation réduite ainsi que les suites opératoires pour le patient, tout en restant un protocole simple à réaliser. (5) Fig.1
I : Physiologie de l’extraction simple :
La physiologie de la cicatrisation alvéolaire a bien été décrite dans la bibliographie, (6) une fois l’avulsion réalisée et dès les premières minutes, un caillot sanguin se forme et de nombreux remaniements se font les jours et les semaines suivants : les phénomènes engendrés sont la détersion du caillot et son remplacement petit à petit par une matrice provisoire à consolidation centripète. Dès le 3è jour, le caillot se nécrose et est remplacé par un tissu de granulation très richement vascularisé. Au jour 7, on note l’apparition d’une matrice provisoire constituée de vaisseaux sanguins, leucocytes, et de fibres de collagène.
Au 14ème jour, le modelage/remodelage se fait par l’intermédiaire du tissu conjonctif.
Il faut attendre 2 mois pour voir apparaître un os tissé, fibreux, future trame d’un os qui ne sera mature qu’à 6 mois minimum.
Histologiquement, le ligament alvéolaire joue un rôle essentiel en faisant le lien entre la paroi osseuse et le caillot néo formé.
La fermeture du site se fait donc sur plusieurs jours et très souvent on observe rapidement un effondrement physique de la partie buccale, les études associent cette perte a une inflammation liée à la contamination de la partie superficielle du caillot par la salive et les bactéries. (6)
L’idéal cellulaire en termes de cicatrisation se trouve dans le tiers apical de l’alvéole ; là où le caillot est protégé de toute interaction salivaire et buccale.
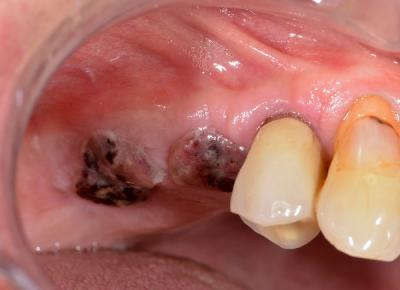
Fig.2 et Fig.3
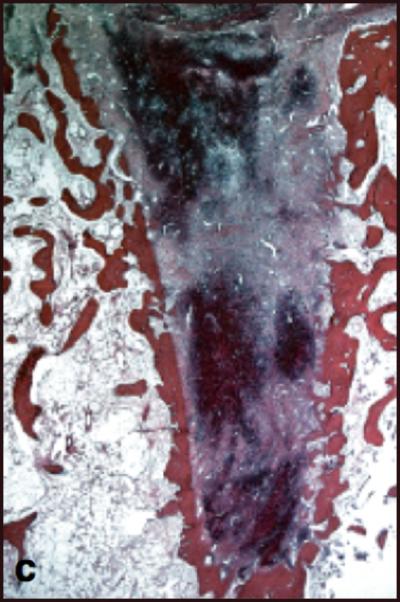
Fig.2
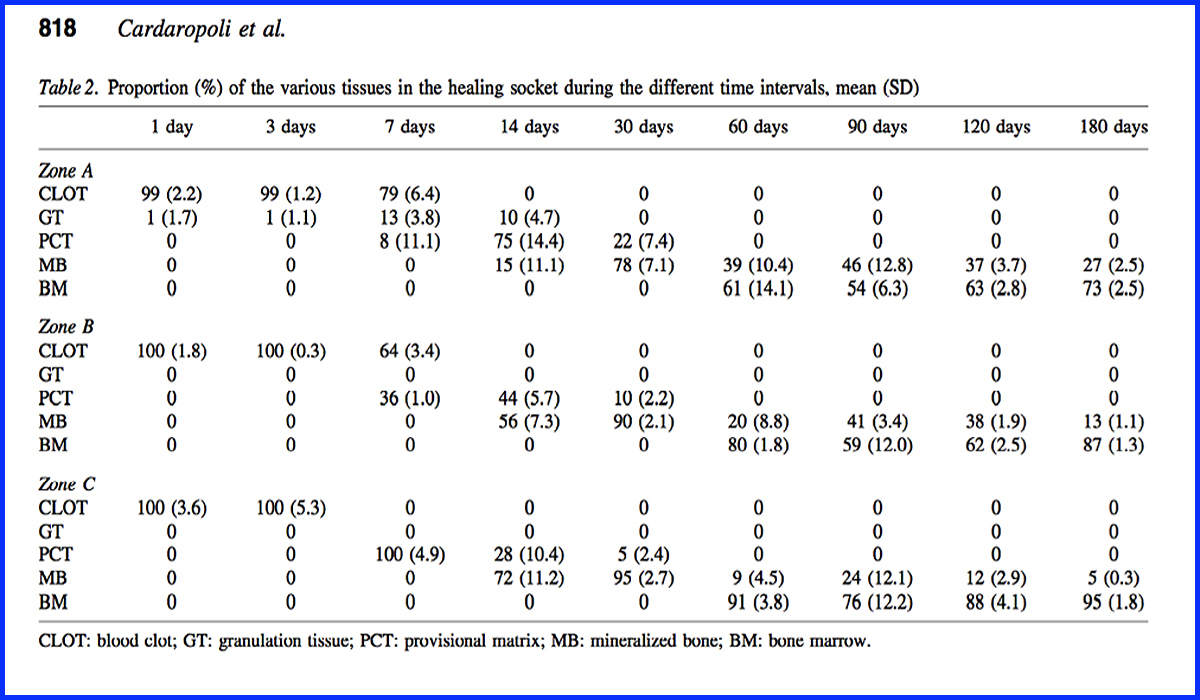
Fig.3
Selon l’étude de Cardaropoli et coll (6) la composition du caillot est très différente selon sa position verticale dans l’alvéole. Fig.3
En A et B, la cicatrisation est retardée, comme le montre les chiffres à 7 jours et jusqu'à maturation osseuse
En revanche dans la partie C, la plus apicale, le tissu cicatriciel est composé de 100% de caillot sanguin (au potentiel de réparation le plus important) alors que plus on se rapproche de la surface et plus les composants inflammatoires se multiplient.
Ces observations histologiques et cellulaires nous ont amené lors des dernières décennies à fermer les alvéoles avec des matériaux et/ou les suturer.
Les résultats sont malgré tout relativement inconstants et dépendent des matériaux utilisés, de l’opérateur et de la biologie du patient. (7) Sans compter le coût de matériaux adjoints et sutures éventuelles.
L’idéal, si on reprend la physiologie, est d’avoir un tissu sanguin pré cicatriciel dans l ‘alvéole, qui dès les premières minutes, est constitué de 100% de caillot, gélifié, semi solide c’est à dire qu’il soit suffisamment stable pour ne pas être « contaminé » par la salive et déstabilisé par les bactéries, le stade inflammatoire est de ce fait supprimé et on peut espérer obtenir une quantité d’os cicatriciel supérieure à ce que l’on aurait avec une alvéole non traitée.
C’est ce que 10 années de cas cliniques traités confirment.
Le deuxième objectif recherché est d’obtenir une surface superficielle du caillot, très stable mécaniquement, de façon à offrir aux cellules épithéliales périphériques une colonisation rapide et aisée.
II : Interaction lasers – caillot sanguin
La connaissance du fonctionnement des lasers est indispensable à l’obtention d’un résultat efficace.
Pour interagir avec le sang, avec une absorption maximale, les lasers ionisants sont de choix.
Une deuxième façon de coaguler le sang est d’utiliser les effets thermiques de longueurs d’ondes entre 800 et 1100 nm, qui sont également bien absorbées par le sang et la combinaison des deux permet une interaction sélective sur le caillot sanguin et donc nous mène à un résultat plus efficace. Le protocole PAL utilise cette deuxième façon de coaguler le sang.
Les effets thermiques des lasers reposent sur trois notions importantes: la conversion de la lumière en chaleur, le transfert de chaleur et le processus de dénaturation tissulaire.
L ‘absorption dépend de la structure protéique du tissu, et de ses propriétés physico-chimiques. Ses propriétés optiques sont directement liées à sa composition
Dans le sang, le faisceau laser irradiant est absorbé par l’eau, l’hémoglobine et l’oxy hémoglobine principalement, ce sont les chromophores du sang.
Comme le montre la figure 4, cette absorption dépend de la longueur d’onde utilisée, on note une très forte absorption sur des longueurs d’onde entre 400 et 500nm, mais les lasers diodes classiquement proposés entre 800 et 1100nm permettent une très bonne absorption dans l Hg et l’ oxy Hg mais également dans l ‘eau, ils sont donc les lasers de référence pour stabiliser un caillot, mais aussi les lasers Nd Yag (1064nm) lasers vasculaires (créés en 1973) qui présentent également les bonnes capacités a être absorbés dans ce tissu sanguin. (7)
Revenons sur la première phase de chauffage du tissu ; lorsqu’un apport thermique est délivré dans le tissu sanguin, on observe la transformation d’Hg en Met hémoglobine, protéine trouvée dans le sang des poumons après oxygénation, pour un taux qui n’excède jamais 3%. (8)
Lorsque le sang est irradié, le taux de Met Hg augmente très largement pour devenir majoritaire dans le liquide.
Ce qui nous intéresse, c’est de savoir que les propriétés physico chimiques et donc en conséquence optiques du sang, découlant de cette irradiation sont modifiées, en effet l’absorption de l’irradiation laser, (entre 800 et 1100nm), est augmentée d’un facteur 4,5 par rapport a l’oxy Hg et 20 par rapport à l’Hg.
Fig.5
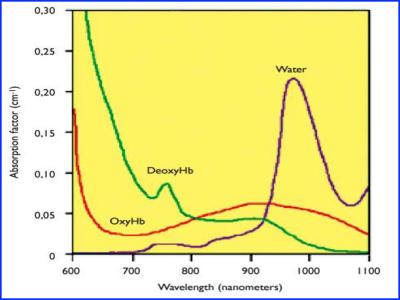
Fig.4
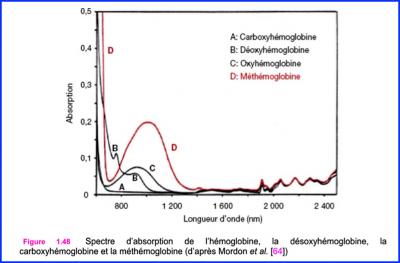
Fig.5
L’absorption améliorée de la Met Hg, pour une irradiation diode ou Nd Yag, permet une coagulation laser plus efficace, en évitant le phénomène de transfert de chaleur aux tissus environnants.
L’intérêt majeur de l’utilisation d’une longueur d’onde pénétrante, est incontestablement l’apport d’effets cellulaires et tissulaires majeurs et multiples : augmentation de la production d’ATP, stimulation de nombreux photo récepteurs membranaires cellulaires, des mitochondries, des membranes nucléaires qui induisent des réactions en chaine d’oxydation initiatrices d’effets de prolifération cellulaire, de facteurs de croissance entre autres, mais un effet nous intéresse plus particulièrement, la néo angiogenèse et la prolifération des cellules endothéliales. Les auteurs (8) ont montré que la réduction de sPRGF A et l’augmentation de PRGF A ont pour conséquence directe une meilleure réparation vasculaire sur des irradiations de faible énergie ; 2 à 4J/cm2 sur une irradiation diode de 635nm
Cas Cliniques et protocole PAL :
Cas n°1 : Patient présentant des caries sous gingivales palatines en 23/24 et infections apicales ; on note une rupture du système d’attache en vestibulaire de 24, qui laisse craindre un effondrement des tissus après extraction. (Fig.6)
L’avulsion de ces 2 dents est réalisée selon le protocole de PAL suivant : syndesmotomie après anesthésie locale articaine 1/200è, mobilisation précautionneuse de 23/24, et avulsion des 2 racines.
Curetage alvéolaire pour ablation du tissu de granulation, dépôt d’H2O2 dans l’alvéole et irradiation 980nm pour décontamination. (9)
Laser Erbium Yag, 200mJ, 20Hz, pour un effet de cavitation dans l’alvéole ce qui crée une désinfection du contenu alvéolaire par vaporisation du tissu de granulation et irradiation des parois alvéolaires.
Dans un deuxième temps, irradiation 980nm, puissance 6W, Ti on 47 microsecondes, Ti off 247 microsecondes, avec un mouvement balayant toute la hauteur de l’alvéole.
Après 80 Joules d’irradiation, l’alvéole est remplie d’un tissu sanguin abondant (la vasodilatation et la néo angiogenèse sont des effets secondaires à l’irradiation diode)
La deuxième étape sera le chauffage du caillot pendant 30 secondes : 2W, Ti on 1ms, Ti off 1ms
La coagulation peut commencer : 2W, 2ms de Ti on et 1ms de Ti off
La gélification du caillot se produit et la dernière étape de calcination superficielle mène à la soudure des berges épithéliales, le tissu solidifié a toutes les propriétés pour une prolifération rapide des cellules épithéliales et donc une fermeture rapide du site.
La cicatrisation à 4 jours (Fig.7) montre une très bonne vascularisation et l’absence de perte de volume primaire de l’alvéole.
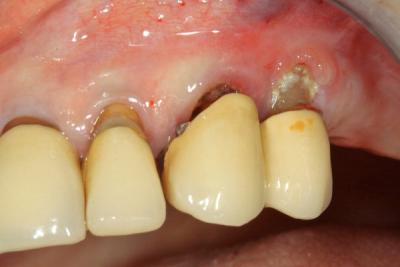
Fig.6 - Etat initial
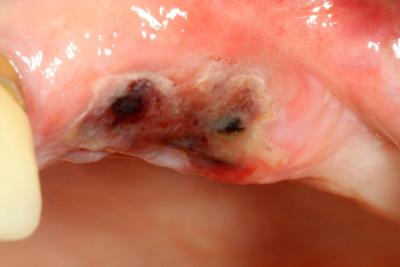
Fig.7- Cicatrisation à 4 jours
Cas clinique 2 :
Patient présentant une perte osseuse importante autour de l’ensemble des dents maxillaires, mobilités terminales , perte de gencive attachée et infections péri apicales, l’ensemble des dents sont extraites selon le protocole de PAL
La mise en place de 6 implants est prévue 4 mois après.
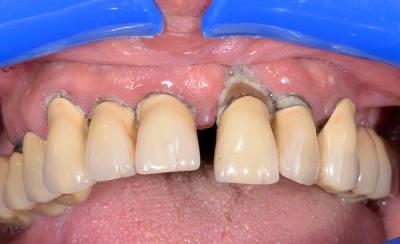
Fig.8
Dans ce cas, un passage final avec une pièce à main esthétique PSO4, 2Hz, sans air et sans eau, permet d’obtenir une prolifération de fibrine plus importante.
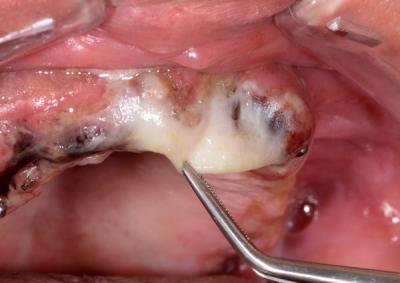
Fig.9 - Fibrine à 24 H
Ce protocole, qui repose sur une expérience clinique de dix ans, de nombreux cas traités, montre des régénérations alvéolaires rapides et intéressantes, avec une fermeture physique rapide des alvéoles, moins d’inflammation et de douleurs, il sera nécessaire de compléter ces applications par des études histologiques, afin de déterminer la composition cellulaire du caillot cicatriciel.
Bibliographie :
- Lambert F, Vincent K, Rompen E. A methodological approach assessing alveolar ridge preservation procedures in humans : hard tissue profile. J Clin Periodontol 2012 ; 39 :887-894
- Araujo, M. G., Sukekava, F., Wennstrom, J. L. & Lindhe, J. (2005) Ridge alterations following implant placement in fresh extraction sockets: an experimental study in the dog. Journal of Clinical Periodontology 32, 645–652.
- Araujo, M. G. & Lindhe, J. (2005) Dimensional ridge alterations following tooth extraction. An experimental study in the dog. Journal of Clinical Periodontology 32, 212–218.
- Tan WL, P.Lang N. ; A systematic review of post extractional alveolar hard and soft tissue dimensional changes in humans ; Clin.Oral.Impl.Res 23 ;2012 ; 1-21
- Maleca T, Préservation alvéolaire Postextractionelle, intérêt de l’utilisation des lasers diode. Clinic 2014 : 35 :417-420
- Cardaropoli G, Araujo M, Lindhe J. Dynamics of bone tissue formation in tooth extraction sites. An experimental study in dogs. J Clin Periodontol, 2003 Sep 30 (9) : 809-18
- Moritz.A. Oral laser applications ; quintessenz-2006 :40-52
- Cartier.H ;Dahan.S ; Toubel.G, Les lasers en dermatologie, 3è édition`
- Rey G, Missika P. Les lasers et la chirurgie dentaire. Ed. CdP, Rueil- Malmaison, 2010.
- Goralczyk.G ; Szymanska.J ; effect of LLLT on endothelial cells culture ; Lasers Med Sci (2015) 30 :273-278
- Aoki A, Sasaki K, Watanabe H, Ishikawa I. Lasers in non-surgical perio- dontal therapy. Periodontol 2000, 2004; 36: 59-97.
- OhshiroT,CalderheadRG.Developmentoflowreactive-levellaserthe- rapy and its present status. J Clin Laser Med Surg 1991 ; 9 (4) : 267-275.
- Agrawal T et al. Pre-conditioning with low-level laser (light) therapy: light before the storm. Dose Response.2014 22 ; 12 (4) : 619-649.
- Sikka G et al. Melanopsin mediates light-dependent relaxation in blood vessels. Proc Natl Acad Sci U S A 2014; 111 (50): 17977-17982.
- Arany PR et al. Activation of latent TGF-beta1 by low-power laser in vitro correlates with increased TGF-beta1 levels in laser-enhanced oral wound healing. Wound Repair Regen 2007; 15 (6): 866-874.